HOME
>
特集
>
パイロトーシスおよびインフラマソーム研究用製品特集
HOME
>
試薬
>
免疫化学
>
炎症
>
パイロトーシスおよびインフラマソーム研究用製品特集
パイロトーシスおよびインフラマソーム研究用製品特集
掲載日情報:2024/06/27 現在Webページ番号:71580
パイロトーシス(ピロトーシス、Pyroptosis)は制御された細胞死(プログラム細胞死)の一種で、インフラマソーム(Inflammasome)と呼ばれるタンパク質複合体によって炎症性CaspaseやIL-1ファミリーのサイトカインが活性化されることにより生じます。
本ページではパイロトーシスおよびインフラマソーム研究に有用な製品をご紹介いたします。
※ 本製品は研究用です。研究用以外には使用できません。
追加しました。
-
2025/07/01
試薬 特別価格
[ARI] HMGB1研究用製品 20%OFFキャンペーン [~2025/09/30]
期間:2025/07/01 ~2025/09/30
Arigo Biolaboratories Corp.(ARI)
パイロトーシスおよびインフラマソームについて
パイロトーシスについて
パイロトーシス(Pyroptosis)という現象は、マクロファージの病原体感染によって惹起される「プログラム細胞死」の一種として1992年には既に発見されていましたが1、“パイロトーシス”という科学用語は、2001年、瀕死の細胞からIL-1βやIL-18といった炎症性サイトカインが急速に放出される現象を説明する際にギリシャ語のpyro(火あるいは熱)とto-sis(落ちる)2を組み合わせたものとして初めて使用されました。パイロトーシスは、感染した細胞を排除し、病原体抗原を露出させることで細胞内感染と戦うのに役立ちますが、宿主の防御には限定されません。SARS-CoV-2のようなウイルスの一部はパイロトーシスを誘発し、「サイトカインストーム」として知られる過剰な免疫反応の発症に寄与する可能性があります3。
長年の研究により、パイロトーシスのメディエーターがいくつか特定されてきました。初期の研究では、カスパーゼ-14への依存が示されていましたが、現在では、カスパーゼ-4、-5、-11などもパイロトーシスを媒介できることが明らかになっています5。
活性化するカスパーゼの種類によって、シグナル伝達経路は標準的(canonical)なシグナル経路(カスパーゼ-1)と非標準的(non-canonical)なシグナル経路(カスパーゼ-4、-5、-11)に分類されます6。標準的な経路では、傷害(DAMPs)や病原体関連分子パターン(PAMPs)などの異なる刺激に反応する多量体のタンパク質複合体であるNLRP3インフラマソームなどのインフラマソームによってカスパーゼ-1が活性化されます。非標準的な経路では、パイロトーシスを引き起こすカスパーゼが、グラム陰性菌の細胞内リポ多糖(LPS)の受容体として直接機能し、二次的にNLRP3インフラマソームを活性化させます7。
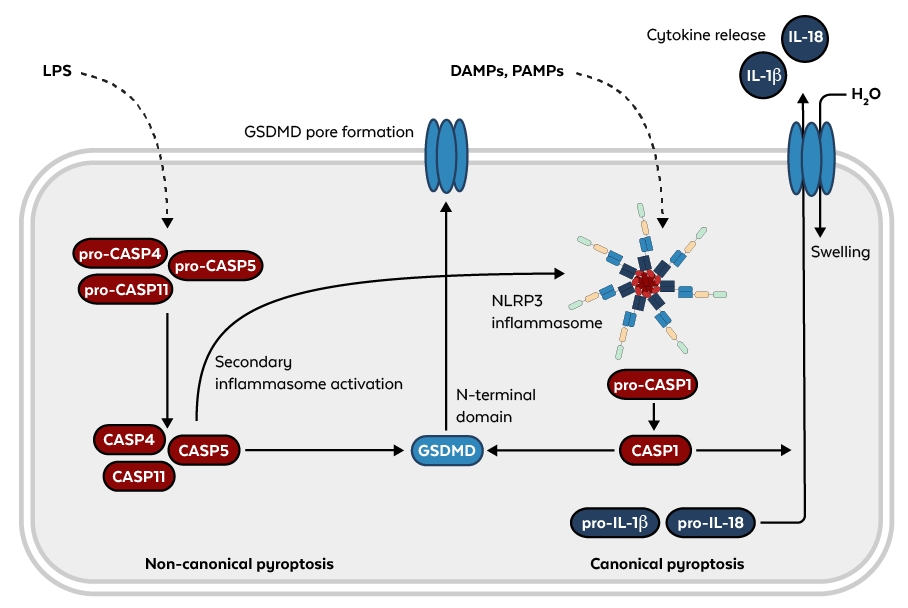
図. パイロトーシスの非標準的経路(左)と標準的経路(右)
図中のガスダーミンD(Gasdermin D、GSDMD)は、保存された構造を持つタンパク質ファミリーに属します。GSDMDはカスパーゼによって切断・活性化され、N末端のガスダーミンドメインを放出して細胞膜に孔が形成されます。また、カスパーゼ-1はpro-IL-1βとpro-IL-18を切断し、成熟サイトカインを生成します。これらのサイトカインは、H2Oの流入と膜の破裂に先立ってこれらの膜孔を通して放出されます8。この経路のさまざまな構成要素と相互作用は理解され始めたばかりですので、将来、さらに多くの知見が得られることが期待されています。
参考文献
- Zychlinsky, A., et al., "Shigella flexneri induces apoptosis in infected macrophages." Nature, 358(6382), 167~169 (1992). [PMID: 1614548]
- D'Souza, C.A., and Heitman, J., "Dismantling the Cryptococcus coat." Trends Microbiol., 9(3), 112~113 (2001). [PMID: 11303499]
- Ferreira, A.C., et al., "SARS-CoV-2 engages inflammasome and pyroptosis in human primary monocytes." Cell Death Discov., 7(1), 43 (2021). [PMID: 33649297]
- Hilbi, H., et al., "Shigella-induced apoptosis is dependent on caspase-1 which binds to IpaB." J. Biol. Chem., 273(49), 32895~32900 (1998). [PMID: 9830039]
- Man S.M., et al., "Converging roles of caspases in inflammasome activation, cell death and innate immunity." Nat. Rev. Immunol., 16(1), 7~21 (2016). [PMID: 26655628]
- Wei, X., et al., "Role of pyroptosis in inflammation and cancer." Cell. Mol. Immunol., 19(9), 971~992 (2022). [PMID: 35970871]
- Downs, K.P., et al., "An overview of the non-canonical inflammasome." Mol. Aspects Med., 76, 100924 (2020). [PMID: 33187725]
- Kovacs, S.B., and Miao, E.A., "Gasdermins: Effectors of Pyroptosis." Trends Cell Biol., 27(9), 673~684 (2017). [PMID: 28619472]
インフラマソームについて
インフラマソーム(Inflammasome)は、炎症やアポトーシスに関与するタンパク質の複合体で、炎症性CaspaseやIL-1ファミリーのサイトカインを活性化します。これまでに、NLRP1(NALP1)Inflammasome、NLRP3(NALP3)Inflammasome、IPAF(NLRC4)Inflammasome、AIM2 Inflammasomeの4種類が報告されており、そのうちの前者3種はNLRタンパク質を含んでいます。
Inflammasomeは、バクテリア生菌、微生物由来毒素、生体異物、PAMPs(病原体関連分子パターン)、DAMPs(ダメージ関連分子パターン)などさまざまな刺激により活性化されます。
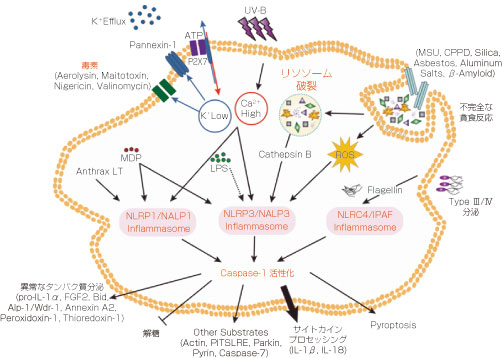
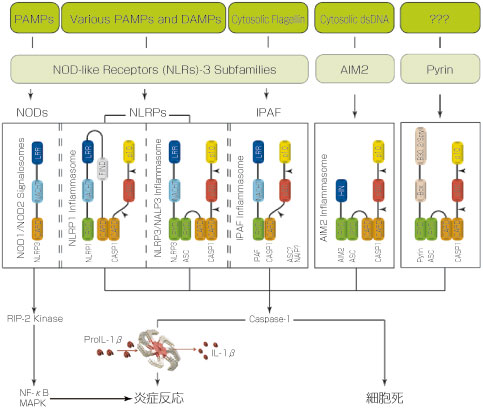
NLRP3/NALP3インフラマソームの活性化について
NLRP3/NALP3インフラマソーム活性化の正確なメカニズムはまだ議論中ですが、研究者の間では下記の3つのモデルが支持されています。
- NLRP3インフラマソームアゴニストである細胞外ATPは、そのレセプターであるP2X7に結合し、K+流出とパネキシン-1膜孔形成を引き起こします。後者は、直接的なNLRP3活性化因子となり得る細胞外因子の侵入を可能にしている可能性があります。また、NLRP3がK+の流出または膜の完全性を感知している可能性も示唆されています。
- MSU、ミョウバン、シリカ、アスベストなどの貪食された結晶性または粒子状のNLRP3リガンドは、リソソーム内容物のサイトゾルへの放出につながる機械的損傷により、リソソームの不安定化と破裂を引き起こす可能性があります。この経路はカテプシンB阻害物質であるCA-074-Meに感受性があり、リソソームプロテアーゼであるカテプシンBが直接NLRP3リガンドの活性化に関与していることが示唆されました。しかしながら、カテプシンB欠損マクロファージにおいて、MSUやミョウバンなどのNLRP3リガンドに応答したIL-1β分泌およびカスパーゼ-1切断の変化は観察されませんでした。NLRP3が細胞質のリソソーム含有量をどのように感知するかはまだ分かっていません。
- 3番目のモデルには、活性酸素種(ROS)の生成が含まれます。試験したすべてのNLRP3アゴニストは、ROSの生成を引き起こし、さらに、ROSスカベンジャー(捕捉物質)はNLRP3の活性化を抑制します。ROSの細胞内発生源は現在不明であり、ROSはNLRP3インフラマソームの活性化に必要であるように思われますが、それだけでは十分ではありません。B細胞では、ROS感受性NLRP3リガンドであるTXNIP(チオレドキシン相互作用タンパク質;VDUP1)がNLRP3活性化のトリガーとして関与していることが示されました。
NLRP1と同様に、NLRP3活性化におけるもう1つの重要なパラメーターは、細胞質のK+濃度であると思われます。高いK+濃度で培養されたマクロファージが、NLRP3依存性カスパーゼ-1活性化の低下を示すという事実は、K+流出がNLRP3活性化の上流に必要であることを示唆している可能性があります。
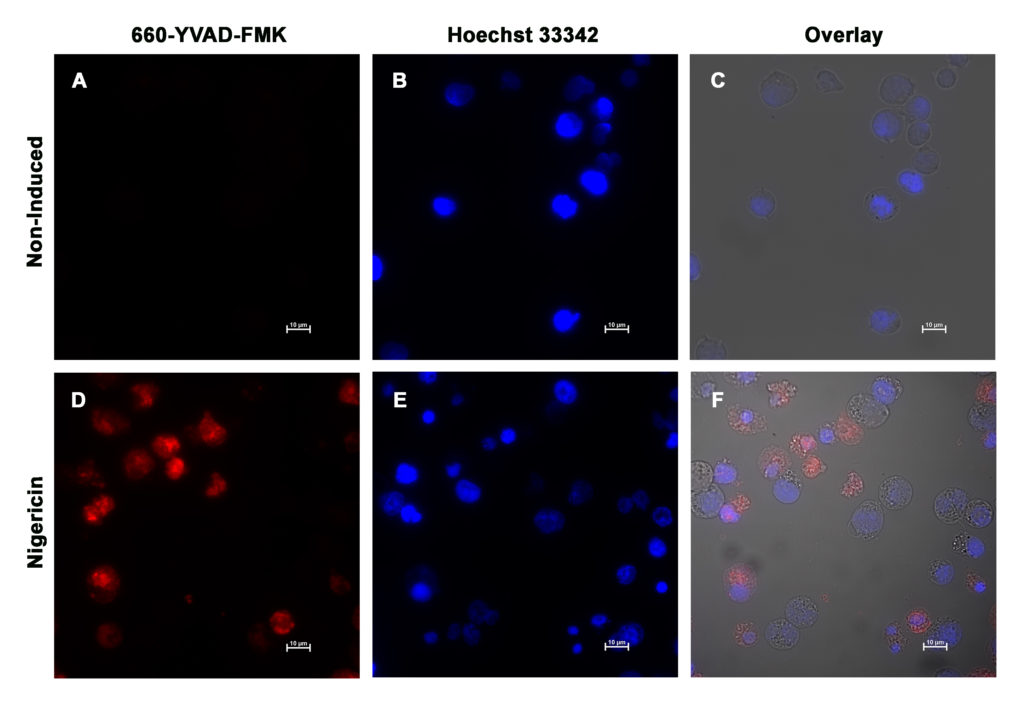
パイロトーシスにおけるCaspase-1について
カスパーゼ-1は、最もよく注目されている炎症性カスパーゼです。サイトカインであるインターロイキン-1β(IL-1β)およびIL-18に作用して、パイロトーシスを誘導します。多数の刺激に応答し、インフラマソーム(Inflammasome)と呼ばれる多タンパク質複合体によって活性化されます。NLRC4は細胞質フラジェリンに、マウスNLRP1bは炭疽菌毒素に、AIM2は細胞質DNAに、そしてNLRP3はさまざまなアゴニストに応答します。
パイロトーシスにおけるGSDMDについて
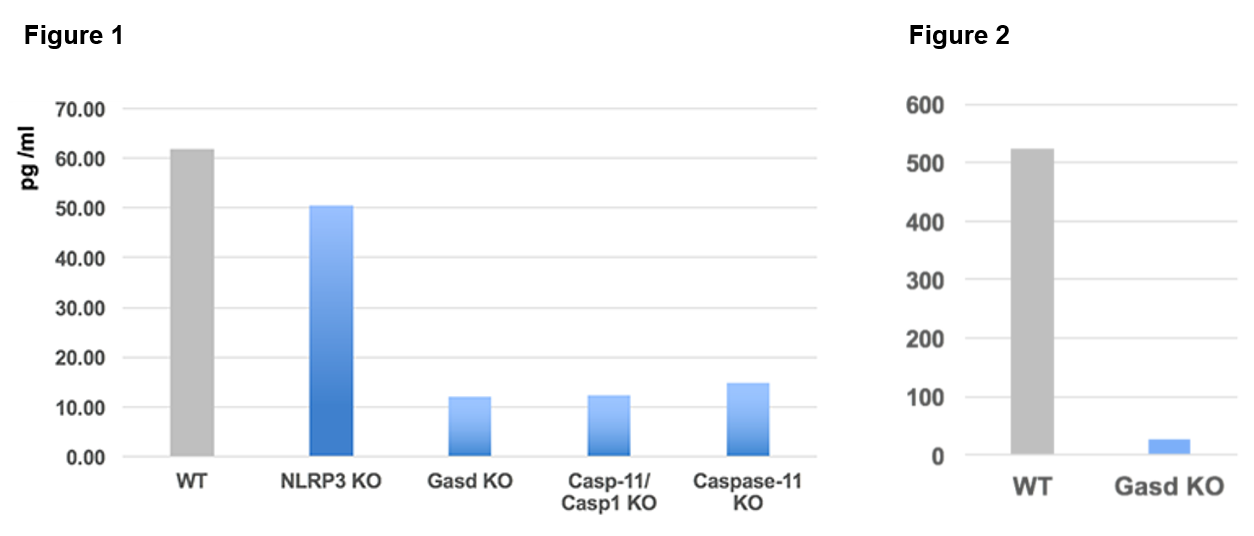
GSDMD(ガスダーミンD、Gasdermin-D)は、インフラマソーム活性化因子に応答した炎症性カスパーゼCASP1またはCASP4によって切断されます。切断後、細胞膜に移動したGSDMDの断片は、内葉の脂質に結合します。膜内でホモオリゴマー化し、内径10~15 nmの孔を形成することにより、成熟型IL-1βの放出とパイロトーシス(Pyroptosis)を誘発すると考えられています。
パイロトーシスを起こした細胞から細胞外に放出されたGSDMDのN末端は、脂質結合特異性により外側から細胞膜を破壊しないため、隣接する哺乳類細胞を傷つけることなく、グラム陰性菌およびグラム陽性菌の両方に速やかに結合して死滅させます。細胞培養条件下では、Listeria monocytogenes(リステリア・モノサイトゲネス)のような細胞内細菌に対しても活性を示し、カルジオリピンを含む細菌およびミトコンドリアの脂質に強く結合します。
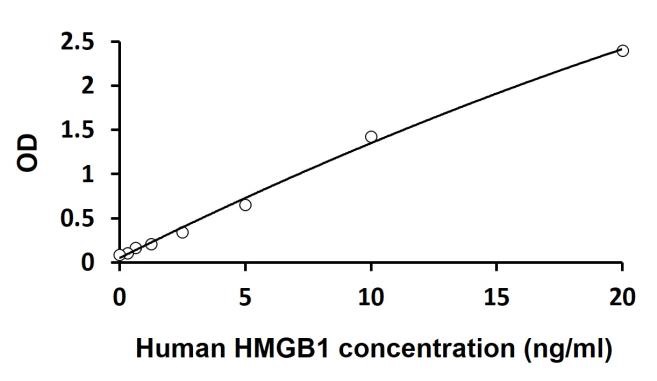
パイロトーシスにおけるHMGB1について
HMGB1(High Mobility Group Box 1)は細胞局在によって異なる役割をもつ多機能性タンパク質です。例えば、がん細胞において、細胞内ではゲノムを安定化させる抗腫瘍タンパク質として作用し、細胞外では免疫抑制機能をもつ前腫瘍タンパク質としての働きをもちます。
炎症細胞死であるパイロトーシスは、防御応答を増強することによって病原体の迅速なクリアランスを促進します。HMGB1は、DAMP(Damage-associated molecular pattern)として機能し、炎症性サイトカインIL-1およびIL-18の成熟およびGSDMD膜孔の形成に寄与するNLRP3インフラマソームの形成を開始し、炎症性サイトカインの放出を促します。
追加しました。
パイロトーシス・インフラマソーム関連の技術資料および動画
Adipogen社技術資料
画像をクリックするとpdfをご覧になれます。