HOME
>
試薬
>
免疫化学
>
免疫染色(免疫組織染色)
>
免疫組織染色用関連商品
>
免疫化学実験用レクチン(Vector社)
HOME
>
試薬
>
天然物/有機化合物/糖質
>
レクチン
>
レクチン
>
免疫化学実験用レクチン(Vector社)
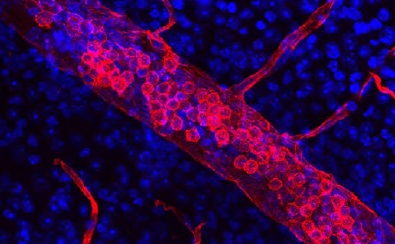
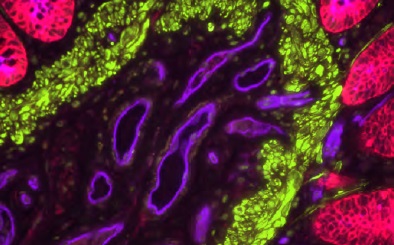
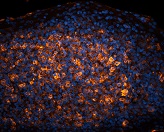
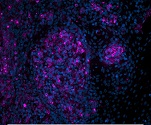
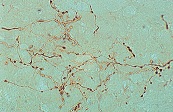
神経組織染色に最適なレクチン 免疫化学実験用レクチン(Vector社)
掲載日情報:2020/06/02 現在Webページ番号:7443
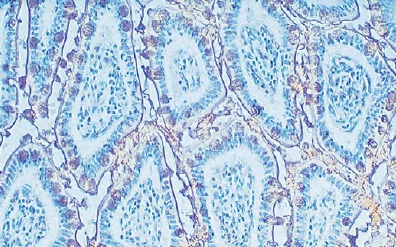
免疫組織染色、ウエスタンブロッティング、ELSAなどで糖タンパク質の検出に便利なできる各種レクチンです。神経組織の染色にも最適です。
追加しました。
- 使用例
- レクチン(Lectin)とは
- 製品の種類
- Concanavalin A (Con A)・価格
- Dolichos biflorus Agglutinin (DBA)・価格
- Griffonia (Bandeiraea) simplicifolia Lectin Ⅰ (GSL Ⅰ、BSL Ⅰ)・価格
- Lycopersicon esculentum (Tomato) Lectin (LEL)・価格
- Peanut Agglutinin (PNA)・価格
- Phaseolus vulgaris Agglutinin (PHA)・価格
- Ricinus communis Agglutinin Ⅰ (RCA Ⅰ)・価格
- Soybean Agglutinin (SBA)・価格
- Ulex europaeus Agglutinin Ⅰ (UEA Ⅰ)・価格
- Wheat Germ Agglutinin (WGA)・価格
- Check it out ! その他の神経細胞染色用トレーサー/標識・非標識レクチン
使用例
追加しました。
レクチン(Lectin)とは
レクチンの歴史
ラテン語のlegere(選択する)にちなんで名付けられたレクチン(Lectin)は、赤血球を凝集させる植物タンパク質を起源とする幅広いクラスのグリカン結合タンパク質です。通常、レクチンは「agglutinin(凝集素)」の名称と頭字語を使用して、多くの関連性または互換性のある精製元の生物に由来する名称が付与されています。例えばErythrina cristagalli lectin/Erythrina cristagalli agglutinin (ECL/ECA)、またはSambucus nigra agglutinin (SNA)のように、一般的にレクチンは「属種レクチン/凝集素」で呼称されます。
これらの血球凝集素、または植物由来の植物凝集素は、1888年にPeter Stillmarkによって最初に記述されました。彼は、ヒマ(トウゴマ)の種子(RCA、Ricinus communis agglutinin)から強力な毒素と血球凝集素を分離しました。RCAは、Paul Ehrlichによって、重要な初期免疫学的発見を行うためにも使用されました。1919年には、タンパク質分離を専門とするJames B. Sumnerがタチナタマメからレクチンを分離し、コンカナバリンA(Con A、Concanavalin A)と名付けました。その後、1926年に最初の酵素を結晶化し、1946年にノーベル賞を受賞しました。Con Aを分離してから数年後、James B. Sumnerはショ糖によって阻害される過程において、Con Aが赤血球を凝集させることができることを発見し、細胞表面の炭水化物と相互作用しているという仮説を立てました。
一方で、1960年にはPeter C. Nowellによって、フィトヘマグルチニン(PHA、phytohemagglutinin )がリンパ球に有糸分裂を誘発できることが示されました。この発見により、in vitroにおけるリンパ球の増殖と培養が初めて可能になりました。1963年、Joseph C. Aub は、小麦胚芽凝集素(WGA、wheat germ agglutinin)が悪性がん細胞を優先的に凝集させ、がんに存在するグリコシル化の変化の初期の証拠を示しました。1967年には、GoldsteinとAgrawalは、アフィニティークロマトグラフィーを導入してデキストラン上でConAを精製し、精製レクチンの利用の可能性を広げました。
1974年までは、レクチンは植物、無脊椎動物、下等脊椎動物にのみ存在することが示されていましたが、同年、AshwellとMorellにより、最初の哺乳類レクチンであるAshwell-Morell Receptor(AMR)の存在が実証されました。これは肝臓に存在し、血流中の糖タンパク質と細胞の半減期に影響を与えます。翌年には、Vivian Teichbergが、デンキウナギから最初のβ-ガラクトースレクチンを単離し、またガレクチンファミリーのタンパク質を発見しました。これらの高度の免疫調節性分子は、今日でも活発に研究されています。
1976年には、Irvin E Lienerにより、カブトムシに黒豆レクチンを与えるとカブトムシの幼虫が死んだと報告され、これが植物レクチンの生理学的役割の最初の証拠となりました。レクチンのこの殺虫作用は、WGA、Galanthus nivalis lectin(GNL)、ジャカリン(Jacalin)などの他のレクチンにも見られます。SharonとLisは、「レクチンは、植物で血球凝集素として最初に検出されて以来、無数の刺激的な機能と用途を備えたユビキタス認識分子として、現在に至るまでの長い道のりを歩んできました。」と語っています。
レクチンの適用
ある種のレクチンは、害虫駆除や、抗真菌性を有していることが示されています。糖鎖付加はがん細胞の特性であり、多くの植物レクチンはin vitroでがん細胞に対して有望な抗がん効果を持つことが示されています。植物レクチンは抗ウイルス特性を有しており、増殖阻害や、コロナウイルスとHIVのビリオンの付着を抑制することが示されています。レクチン-gp120グリカンの相互作用がHIVの融合阻害をもたらす多数の報告があり、またバナナ由来レクチン(BanLec)のHIV複製阻害作用も実証されています。また、HIV中和抗体の免疫および誘発のためのgp120を模倣したカスタム糖ペプチドを、植物レクチンのGNLを使用して精製する方法も報告されています。
Vector Laboratories社(以下、Vector社と略記)が提供する「Lectin Application and Resource Guide」の中では、免疫組織化学(IHC)、免疫蛍光(IF)、フローサイトメトリー、セルソーティング(FACS)、アフィニティークロマトグラフィー、ELISA、ウエスタンブロッティング、表面プラズモン共鳴(SPR)、細胞増殖、神経トレーシング、およびin vivoでのかん流におけるでレクチンを利用方法の例を解説しています。
※ Lectin Application and Resource Guideの序説からの抜粋・和訳
レクチンガイドブック
下の図をクリックすると、Vector Laboratories社が提供する「Lectin Application and Resource Guide」をダウンロードいただけます。
National Center for Functional Glycomics (NCFG)で裏付けされた高品質レクチン製品
Vector Laboratories社のレクチン製品ラインナップは、National Center for Functional Glycomics (NCFG)により、Consortium for Functional Glycomics(CFG)glycan arrayを用いて検証されています。NCFGによる各レクチンロットのグリカン特異性の分析データは、NCGGのウェブサイトで公開されています。このプロジェクトの目標は、厳密で再現性のある糖鎖生物学実験を支援することです。これらのデータは以下に挙げるような項目が含まれており、糖タンパク質の糖鎖構造に対する独自の貴重な洞察が可能となります。
- アレイ内の数百のグリカン構造それぞれに対する各レクチンの結合特異性
- データは集計し、便利な結合配列としてまとめられています。ピークの高さは、各グリカンの結合の程度を示しています。
- 複雑な炭水化物構造に関する具体的かつ詳細なデータ
- 各ロット毎の固有のデータ:結合データの再現性における信頼性の確保のため
追加しました。
製品の種類
項目をクリックすると製品の詳細をご覧いただけます。
追加しました。
Concanavalin A (Con A)・価格
- 由来:Canavalia ensiformis(Jack bean)タチナタマメの種子
- 概要:Con Aは血清や膜の糖タンパク質に広く存在する糖構造、α-結合マンノースを認識するので広く利用されています。例えばホルモンレセプターの研究、有糸分裂の測定、正常および悪性腫瘍細胞の解析、糖タンパク質の精製、ウイルス抗原の単離、デキストランおよびマンナンの分別、細胞凝集の研究、細菌の凝集、膜の流動性と側方移動度の研究、糖の濁度測定、リンフォカインの産生など。
中性およびアルカリ性では、Con Aは約26,000 Daの同一のサブユニットの四量体として存在します。pH5.6以下では52,000 Daの活性ダイマーに解離します。アセチル化、サクシニル化または他の誘導体にすると安定な二量体構造を形成します。
Con AはpH5に等電点を持ち、その4個のそれぞれの糖結合部位にカルシウムまたはマンガンイオンを必要とします。これらの二価の金属イオンはポリペプチド構造に強く結合していますが、カルシウムと結合するリン酸バッファーでCon Aを希釈すると徐々に失活するので、一般に避けなければなりません。
製品ラインナップ
画像をクリックすると拡大図、商品コードをクリックすると各製品の価格表、 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。
| レクチンの種類 | 標識・結合 | 測定波長 | 包装 | 商品コード・価格 | 製品データシート |
|---|---|---|---|---|---|
Concanavalin A |
非標識 | - | 500 mg | L-1000 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
| Agarose | - | 10 ml | AL-1003 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| 100 ml | |||||
| Biotin | - | 5 mg | B-1005 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| FITC | 励起 495~500 nm 蛍光 514~521 nm |
25 mg | FL-1001 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| Rhodamine | 励起 545~555 nm 蛍光 570~580 nm |
25 mg | RL-1002 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
追加しました。
Dolichos biflorus Agglutinin (DBA)・価格
- 由来:Dolichos biflorus(Horse gram)ドリコスマメの種子
- 概要:分子量約111,000 Daの糖タンパク質で、ほぼ同じ大きさの4個のサブユニットから成ります。pH約5.5に等電点を持ち、α-N-アセチルガラクトサミンに対して特異性を有します。DBAはA1血液型細胞を、A2細胞の5,000倍の強さで凝集するので、血液型の識別に用いられます。また赤血球凝集阻止反応により、A1型保有者の分泌型を確認したり、血液型物質のレベルに影響を及ぼすがんの研究にも用いられます。
製品ラインナップ
画像をクリックすると拡大図、商品コードをクリックすると各製品の価格表、 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。
| レクチンの種類 | 標識・結合 | 測定波長 | 包装 | 商品コード・価格 | 製品データシート |
|---|---|---|---|---|---|
Dolichos biflorus Agglutinin |
非標識 |
- | 5 mg | L-1030 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
| Biotin | - | 5 mg | B-1035 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| FITC | 励起 495~500 nm 蛍光 514~521 nm |
2 mg | FL-1031 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| 5 mg | |||||
| Rhodamine | 励起 545~555 nm 蛍光 570~580 nm |
2 mg | RL-1032 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
追加しました。
Griffonia (Bandeiraea) simplicifolia Lectin Ⅰ (GSL Ⅰ、BSL Ⅰ)・価格
- 由来:Griffonia (Bandeiraea) simplicifolia、バンディラマメの種子
- 概要:GSL Ⅰは分子量約114,000 Daの糖タンパク質で、わずかに分子量が異なる“A”および“B”の2つのサブユニットがあります。これらのサブユニットが結合し、四量体を形成して5個のイソレクチンとなります。“A”ユニットを多く含むレクチンは、血液型A赤血球を選択的に凝集し、α-N-アセチルガラクトサミンに特異的であると考えられています。一方“B”サブユニットを多く含むレクチンは、血液型B赤血球を選択的に凝集し、α-ガラクトースに特異的です。VECTOR社のGSL Ⅰは5個のイソレクチンの混合物です。
製品ラインナップ
商品コードをクリックすると各製品の価格表、 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。
| レクチンの種類 | 標識・結合 | 測定波長 | 包装 | 商品コード・価格 | 製品データシート |
|---|---|---|---|---|---|
Griffonia simplicifolia Lectin I |
非標識 | - | 5 mg | L-1100 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
| Biotin | - | 2 mg | B-1105 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| FITC | 励起 495~500 nm 蛍光 514~521 nm |
2 mg | FL-1101 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| 5 mg | |||||
| Rhodamine | 励起 545~555 nm 蛍光 570~580 nm |
2 mg | RL-1102 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
追加しました。
Lycopersicon esculentum (Tomato) Lectin (LEL)・価格
- 由来:トマト果実
- 概要:約50%のアラビノースとガラクトースを含む安定な糖タンパク質。100,000 Daのポリペプチドで、溶液中では凝集していると考えられています。N-アセチルグルコサミンオリゴマーと結合する他のレクチンと同じく、LELもトリマー、テトラマーに選択性を有します。
製品ラインナップ
画像をクリックすると拡大図、商品コードをクリックすると各製品の価格表、 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。
| レクチンの種類 | 標識・結合 | 測定波長 | 包装 | 商品コード・価格 | 製品データシート |
|---|---|---|---|---|---|
Lycopersicon esculentum Lectin |
非標識 |
- | 2 mg | L-1170 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
| Biotin | - | 1 mg | B-1175 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| DyLight 488 |
励起 493 nm 蛍光 518 nm |
1 mg | DL-1174 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| DyLight 594 |
励起 592 nm 蛍光 617 nm |
1 mg | DL-1177 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| DyLight 649 | 励起 655 nm 蛍光 670 nm |
1 mg | DL-1178 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| FITC | 励起 495~500 nm 蛍光 514~521 nm |
1 mg | FL-1171 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| Texas Red | 励起 595~604 nm 蛍光 606~615 nm |
1 mg | TL-1176 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
追加しました。
Peanut Agglutinin (PNA)・価格
- 由来:Arachis hypogaea(Peanuts)ピーナッツ
- 概要:分子量110,000 Daで、約27,000 Daの同一のサブユニット4個から構成されています。
PNAはガラクトシルβ-1、3-N-アセチルガラクトサミンに選択的に結合します。この糖配列(“T-抗原”と呼ばれています)は多くの糖複合体に存在します。例えばMおよびN血液型、ガングリオシド、多くの可溶性膜関連糖タンパク質および糖脂質など。いくつかの例外はありますが、PNAのレセプター配列は通常シアル化されていて、レクチンがそのレセプターオリゴ糖に結合することを妨害しています。レセプター糖に直接結合していないシアル酸ですら結合を阻害します。
PNAは正常組織と腫瘍組織との識別、転位粘膜中の悪性腫瘍の測定に有用です。
また、リンパ組織中の細胞の成熟度の尺度として、ヒトおよび実験動物における種々のリンパ細胞の識別、多くの疾病におけるリンパ球細胞群のレベルの測定、マウスの幹細胞の分画に用いられています。PNAの主要な細胞表面レセプターは、アシアロGM1ガングリオシドの可能性があります。PNAはこの糖脂質に対する抗体と特異性が同一なので、場合によってはPNAと抗体を交換して用いることができます。
製品ラインナップ
画像をクリックすると拡大図、商品コードをクリックすると各製品の価格表、 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。
| レクチンの種類 | 標識・結合 | 測定波長 | 包装 | 商品コード・価格 | 製品データシート |
|---|---|---|---|---|---|
Peanut Agglutinin |
非標識 |
- | 5 mg | L-1070 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
| 25 mg | |||||
| Agarose | - | 2 ml | AL-1073 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| 5 ml | |||||
| Biotin | - | 5 mg | B-1075 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| Cy3 |
励起 552 nm 蛍光 565 nm |
1 mg | CL-1073 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| Cy5 |
励起 650 nm 蛍光 670 nm |
1 mg | CL-1075 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| FITC | 励起 495~500 nm 蛍光 514~521 nm |
5 mg | FL-1071 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
|
| 10 mg | |||||
| Rhodamine | 励起 545~555 nm 蛍光 570~580 nm |
5 mg | RL-1072 |  ※最新のデータシートでない場合があります ※最新のデータシートでない場合があります |
追加しました。
Phaseolus vulgaris Agglutinin (PHA)・価格
- 由来:Phaseolus vulgaris(Red Kidney Bean)インゲンマメの種子
- 概要:4個のサブユニットには2つの異なったタイプがあります。1つは主として赤血球凝集に関与すると思われ、Erythro-agglutininの頭文字をとって“E”サブユニットと名付けられました。もう1つは、リンパ球凝集と有糸分裂活性に関与し、Leucoagglutininの頭文字をとって“L”サブユニットと名付けられました。これらサブユニットが結合して5種のイソレクチンを形成します。
・PHA-Eは4個の“E”サブユニットから成り、強い赤血球凝集活性を示しますが、有糸分裂作用はわずかです。
・PHA-Lは4個の“L”タイプのサブユニットから成り、赤血球凝集反応を示しませんが、強力な有糸分裂作用を示します。その作用は比較的狭い濃度範囲で行われます。
・他の3つのイソレクチンE3L1、E2L2、E1L3は、それぞれ“E”と“L”サブユニットの数に応じて、赤血球凝集活性と有糸分裂活性を示します。
・5つのイソレクチンの混合物をPHA(E+L)と名付けましたが、これらすべてのイソレクチンは、分子量約125,000 Daの糖タンパク質で、等電点はPHA-LがpH5.2、PHA-EがpH6.0、他のイソレクチンはその間の値です。 PHA中に“E”サブユニットが存在すると、最大の有糸分裂促進作用を示す濃度域を拡げるようです。したがってPHA(E+L)は、一般の有糸分裂測定によく用いられます。また、ニューロン追跡用の特異的マーカーとして優れています。
製品ラインナップ
画像をクリックすると拡大図、商品コードをクリックすると各製品の価格表、
 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。レクチンの種類 標識・結合 測定波長 包装 商品コード・価格 製品データシート Phaseolus vulgaris Leucoagglutinin(PHA-L)
非標識
- 5 mg L-1110  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますBiotin - 2 mg B-1115  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますFITC 励起 495~500 nm
蛍光 514~521 nm2 mg FL-1111  ※最新のデータシートでない場合がありますカートに商品を
※最新のデータシートでない場合がありますカートに商品を
追加しました。Ricinus communis Agglutinin Ⅰ (RCA Ⅰ)・価格
- 由来:Ricinus communis(Castor Bean)ヒマ(トウゴマ)の種子
- 概要:中程度の毒性を持つ分子量120,000 Daの糖タンパク質で、60,000 Daの2つのサブユニットから成ります。サブユニットは還元剤により、27,000から33,000 Daの2本の鎖に解離します。一方の鎖は他のヒマレクチンの“B鎖”と共通しており、もう一方の鎖はRCA Ⅰに特異的です。
このレクチンは末端にガラクトースを持つオリゴサッカライドと特異的に結合しますが、N-アセチルガラクトサミンとも結合します。ガラクトースはオリゴサッカライド鎖に一般的に存在する糖です。そのため、このレクチンを使って多くの糖タンパク質の精製が行われています。ほとんどの糖タンパク質は末端にシアル酸基を含んでおり、レクチン結合を阻害することがあるので、脱シアル酸がまず必要になります。
製品ラインナップ
商品コードをクリックすると各製品の価格表、
 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。レクチンの種類 標識・結合 測定波長 包装 商品コード・価格 製品データシート Ricinus communis Agglutinin I RCA120(RCA I)
非標識 - 10 mg L-1080  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますAgarose - 2 ml AL-1083  ※最新のデータシートでない場合があります
※最新のデータシートでない場合があります10 ml Biotin - 5 mg B-1085  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますFITC 励起 495~500 nm
蛍光 514~521 nm5 mg FL-1081  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますRhodamine 励起 545~555 nm
蛍光 570~580 nm5 mg RL-1082  ※最新のデータシートでない場合がありますカートに商品を
※最新のデータシートでない場合がありますカートに商品を
追加しました。Soybean Agglutinin (SBA)・価格
- 由来:Glycine max(Soybean)ダイズの種子
- 概要:ほぼ同じ大きさの4個のサブユニットから成る一群のイソレクチンです。分子量約120,000 Daの糖タンパク質で、pH6.0近くに等電点があります。
SBAは末端部にα-またはβ-N-アセチルガラクトサミンを持つオリゴ糖に、また程度は少し落ちますが、ガラクトースに選択的に結合します。末端から2番目の糖に置換が起こると結合が阻害されます。
SBAは糖タンパク質の分画、組織化学用、セルソーター分析などに用いられます。またヒトの骨髄からの多分化能性幹細胞の分離に用いられます。SBAにより分画された細胞は、宿主に組織移植による疾患を引き起こさないので、組織適合障害を発生させることなく骨髄の移植に用いることができます。
製品ラインナップ
画像をクリックすると拡大図、商品コードをクリックすると各製品の価格表、
 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。レクチンの種類 標識・結合 測定波長 包装 商品コード・価格 製品データシート Soybean Agglutinin
非標識
- 10 mg L-1010  ※最新のデータシートでない場合があります
※最新のデータシートでない場合があります25 mg Agarose - 2 ml AL-1013  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますBiotin - 5 mg B-1015  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますFITC 励起 495~500 nm
蛍光 514~521 nm2 mg FL-1011  ※最新のデータシートでない場合がありますカートに商品を
※最新のデータシートでない場合がありますカートに商品を
追加しました。Ulex europaeus Agglutinin Ⅰ (UEA Ⅰ)・価格
- 由来:Ulex europaeus(Furze Gorse)ハリエニシダの種子
- 概要:31,000および32,000 Daの2個のサブユニットから成る糖タンパク質で、多量体集合体が報告されています。
ABO血液型糖複合体のような、α-結合フコース基を含む多くの糖タンパク質および糖脂質と結合します。血液型O細胞と選択的に結合し、分泌型の決定に用いられています。またヒト内皮細胞のマーカーとして優れています。
製品ラインナップ
商品コードをクリックすると各製品の価格表、
 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。レクチンの種類 標識・結合 測定波長 包装 商品コード・価格 製品データシート Ulex europaeus Agglutinin I
非標識 - 2 mg L-1060  ※最新のデータシートでない場合があります
※最新のデータシートでない場合があります5 mg Agarose - 2 ml AL-1063  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますBiotin - 2 mg B-1065  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますFITC 励起 495~500 nm
蛍光 514~521 nm2 mg FL-1061  ※最新のデータシートでない場合があります
※最新のデータシートでない場合があります5 mg Rhodamine 励起 545~555 nm
蛍光 570~580 nm2 mg RL-1062  ※最新のデータシートでない場合がありますカートに商品を
※最新のデータシートでない場合がありますカートに商品を
追加しました。Wheat Germ Agglutinin (WGA)・価格
- 由来:Triticum vulgaris(コムギ胚芽、Wheat Germ)
- 概要:2つの同一のサブユニットから成る分子量36,000 Daのタンパク質で、pH9付近に等電点を持つイソレクチンのグループから成ります。
WGAのレセプター糖はN-アセチルグルコサミンで、特にこの糖の二量体および三量体と選択的に結合します。
また多くの血清および膜糖タンパク質に共通な構造、すなわち末端にN-アセチルグルコサミンまたはキトビオースを含むオリゴ糖と結合します。
細菌細胞壁ペプチドグリカン、キチン、軟骨のグリコサミノグリカンおよび糖脂質と結合できます。製品ラインナップ
商品コードをクリックすると各製品の価格表、
 をクリックすると製品データシートをご覧いただけます。
をクリックすると製品データシートをご覧いただけます。レクチンの種類 標識・結合 測定波長 包装 商品コード・価格 製品データシート Wheat Germ Agglutinin,
Triticum vulgaris非標識 - 10 mg L-1020  ※最新のデータシートでない場合があります
※最新のデータシートでない場合があります25 mg Agarose - 2 ml AL-1023  ※最新のデータシートでない場合があります
※最新のデータシートでない場合があります5 ml 10 ml Biotin - 5 mg B-1025  ※最新のデータシートでない場合があります
※最新のデータシートでない場合がありますHRP - 2 mg PL-1026  ※最新のデータシートでない場合があります
※最新のデータシートでない場合があります10 mg FITC 励起 495~500 nm
蛍光 514~521 nm5 mg FL-1021  ※最新のデータシートでない場合があります
※最新のデータシートでない場合があります10 mg Rhodamine 励起 545~555 nm
蛍光 570~580 nm5 mg RL-1022  ※最新のデータシートでない場合があります
※最新のデータシートでない場合があります10 mg
カートに商品を
追加しました。Check it out ! その他の神経細胞染色用トレーサー/標識・非標識レクチン
- 神経の細胞内染色に有用なビオチンのアミノ誘導体です。製品の詳細は、NEUROBIOTIN Tracer をご覧下さい。
- レクチンは凝集素とも呼ばれ、糖鎖と結合する性質をもつタンパク質です。オリゴ糖(数糖)の大きさまでの糖鎖の糖配列や結合位置を認識できます。このような性質は免疫機構にも利用され、また研究用のツールとしても有用です。製品の詳細は、標識・非標識レクチンをご覧下さい。
カートに商品を
追加しました。おすすめ製品記事
-
N-Zyme Scientifics, LLC
/ 従来のPNGase Fよりも幅広いN型糖鎖の切断が可能な酵素
PNGase F PRIME™ Glycosidase -
VECTOR LABORATORIES, INC.
/ 糖鎖研究用レクチン
標識・非標識レクチン(Vector Laboratories社) -
VistaLab Technologies, Inc
/ ワンボタンで正確な連続分注を楽々できる電動ピペッター
ali-Q 2 Aliquoting Pipet Controller -
VECTOR LABORATORIES, INC.
内在性ペルオキシダーゼ活性のブロッキング法
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。