HOME
>
試薬
>
脂質
>
LipiDye®-M (Lipid Metabolism Tracer)
HOME
>
試薬
>
細胞培養
>
細胞の解析
>
細胞の染色/トレーサー
>
LipiDye®-M (Lipid Metabolism Tracer)
脂肪酸代謝過程のマルチカラー・ライブセル・イメージング試薬 LipiDye®-M (Lipid Metabolism Tracer)
掲載日情報:2023/02/01 現在Webページ番号:68133

フナコシ /
フナコシ株式会社
[メーカー略称:FNA]
LipiDye®-Mは環境応答性蛍光色素で標識された蛍光標識脂肪酸で、脂質の代謝状態とその周辺環境によって蛍光色が大きく変わるため、脂肪酸の代謝過程を緑色・黄色・赤色蛍光で追跡することができます。脂質代謝の基礎研究や脂質代謝を標的にした創薬研究に有用です。
※ 本製品は名古屋大学 トランスフォーマティブ生命分子研究所 山口茂弘教授、多喜正泰特任准教授の研究成果をもとに、フナコシ株式会社が製品化し、販売しています。
※ 本製品は研究用です。研究用以外には使用できません。
追加しました。
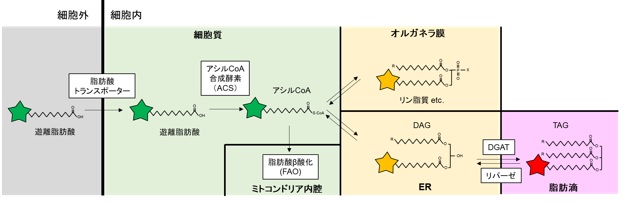
脂肪酸代謝とLipiDye®-Mについて
脂肪酸は脂質の最小単位で、細胞内でアシルCoA、リン脂質、糖脂質、ジアシルグリセロール(DAG)、トリアシルグリセロール(TAG)など様々な脂質構造に変換されます。脂肪酸代謝には多数の酵素が関与し、厳密に制御されており、その破綻は病態にもつながると考えられています。脂質代謝の理解には脂肪酸の代謝過程を解析するツールが求められており、蛍光標識脂肪酸が汎用されていますが、脂肪酸の代謝過程にかかわらず蛍光特性がほとんど変化しないため、各代謝過程を切り分けて分析することが困難とされていました。
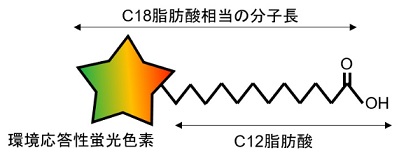
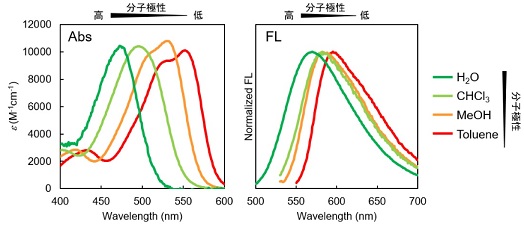
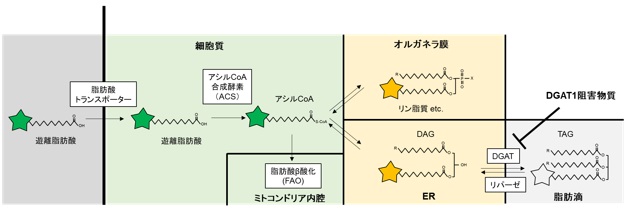
LipiDye®-Mは上記の課題を克服すべく、名古屋大学 トランスフォーマティブ生命分子研究所(ITbM)の山口茂弘教授、多喜正泰特任准教授らにより開発された新規蛍光標識脂肪酸(原著論文名:AP-C12)です。炭素数12の脂肪酸に新規環境応答性蛍光色素アザピレン(Azapyrene)が付加されており、蛍光基を含めるとおよそC18の脂肪酸相当の大きさを有します(図1左)。アザピレンは従来用いられる蛍光色素とは異なり、周囲の分子極性を認識し、吸収波長・蛍光波長がともに変化します。高極性環境(親水性)では緑色、低極性環境(疎水性)になるに従い赤色にシフトする性質を有しています。励起光源と検出波長を適切に選ぶことで、各環境における脂質代謝状況を切り分けて観察できます。
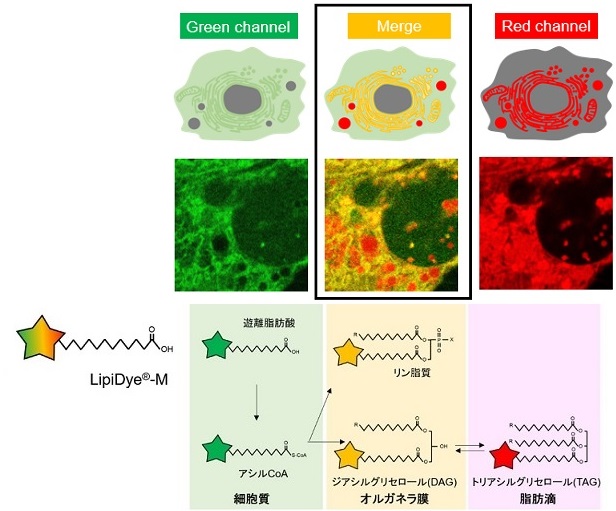
図1:LipiDye®-Mの構造と環境応答性
上記性質により、LipiDye®-Mは脂肪酸トランスポーターを介して細胞内に取り込まれた後、細胞内で脂質代謝を受け各種脂質構造に変換され、それぞれ適切な脂質の局在に移行することで、図2のようにオルガネラごとの極性に応じた蛍光色の変化を誘導します。LipiDye®-Mで生細胞を処理後、蛍光顕微鏡で緑色(励起:450~490 nm、473 nmレーザー推奨/蛍光:490~540 nm)と赤色蛍光(励起540~600 nm、559 nmレーザー推奨/蛍光:570~620 nm)をそれぞれ取得し、重ね合わせることで図3のように脂質代謝の状態を3色に可視化することが可能です。重ね合わせ画像において、細胞質(遊離脂肪酸、アシルCoA)およびミトコンドリア内腔(脂肪酸β酸化代謝物)は緑色、各種オルガネラ膜(リン脂質、DAGなど)は黄色、脂肪滴(TAG)は赤色で主に観察されます。緑色蛍光画像と赤色蛍光画像の各種レシオ解析を行うことで、さらに定量的な解析も可能です。レシオ解析による定量的解析については☞ 原著論文をご参照下さい。
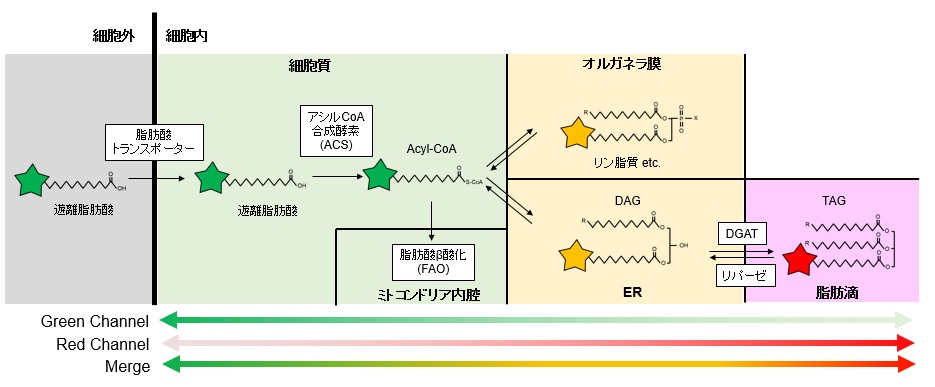
図2:LipiDye®-Mの代謝過程と蛍光変化のイメージ図
図3:LipiDye®-Mによる生細胞3色イメージの模式図
追加しました。
特長
- 脂肪酸の代謝状況・オルガネラ環境によって緑色~赤色に蛍光が変化します。
- 脂肪酸の代謝過程を蛍光イメージングで追跡できます。
- 遊離脂肪酸であるLipiDye®-Mは脂肪酸トランスポーターを介して細胞内に取り込まれたのち、細胞内でアシルCoA、ジアシルグリセロール(DAG)、トリアシルグリセロール(TAG)、リン脂質およびβ酸化代謝分解物に変換されることが確認されています。
- 高極性環境下(細胞質)では緑色、中極性環境下(オルガネラ膜)では黄色、低極性環境下(脂肪滴)では赤色蛍光を示します。
- 緑色蛍光(励起:450~490 nm、473 nmレーザー推奨/蛍光:490~540 nm)と、赤色蛍光(励起:550~600 nm、559 nmレーザー推奨/蛍光:570~620 nm)をそれぞれ取得し、重ね合わせ画像を取得することで定性的な3色イメージング解析ができます。また、緑色/赤色蛍光比を取得することで、定量的なレシオ解析が可能です。
蛍光波長(励起・検出波長)について
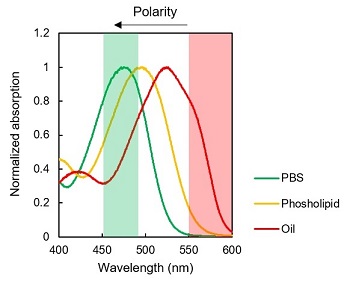
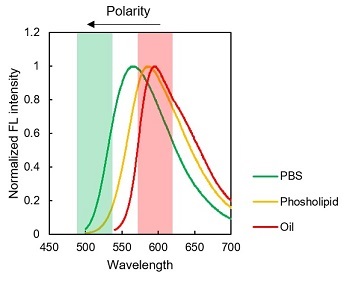
LipiDye®-Mの環境応答性の違いを適切に観察するため、励起波長と蛍光波長は十分に検討が必要です。共焦点レーザー顕微鏡の使用を推奨しています。下記スペクトルを参考に励起光源・検出フィルターをご検討下さい。
| 検出チャンネル | 励起波長域 | 推奨励起波長 | 検出波長域 |
|---|---|---|---|
| 緑色蛍光チャンネル | 450~490 nm | 457, 473 nmレーザー* | 490~540 nm |
| 赤色蛍光チャンネル | 550~600 nm | 559 nmレーザー | 570~620 nm |
| * 488 nm励起は取得蛍光が弱い恐れがあります。 | |||
LipiDye®-MのPBS、リン脂質リポソーム、大豆油中の励起/蛍光スペクトル
追加しました。
アプリケーションデータ
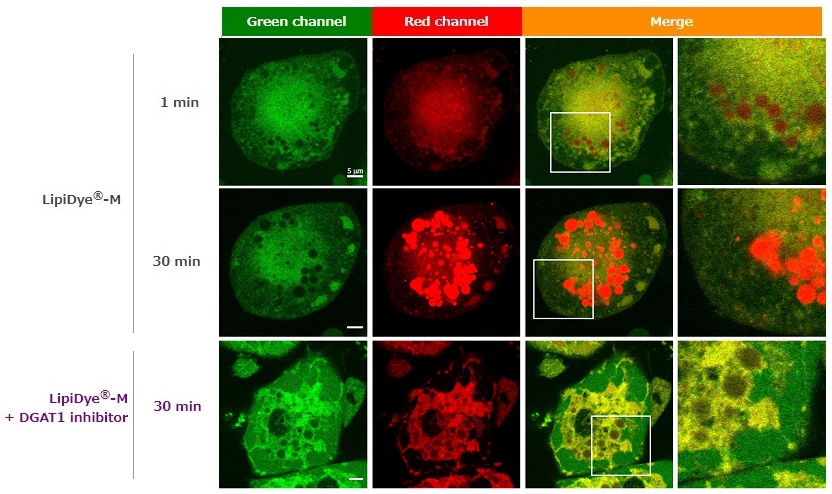
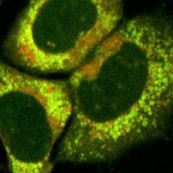
脂肪細胞における取り込み例
図をクリックすると拡大します(
3T3-L1細胞から分化させた脂肪細胞に対し、LipiDye®-M(5 μM)を添加し、添加直後(1分後)および30分後に無洗浄条件下で共焦点レーザー顕微鏡を用いて蛍光観察を行った(Green channel Ex 473 nm / Em 490~540 nm、Red channel Ex 559 nm / Em 570~620 nm)。添加1分後では主に細胞質から緑色のシグナルが強く得られ、脂肪滴由来の赤色シグナルは弱いことから、LipiDye®-Mは遊離脂肪酸やアシルCoAの状態が多く、脂肪滴にまだ十分に取り込まれていないことを示唆する。一方、30分後では緑色シグナルが減少し、脂肪滴の赤色シグナルが強くなっていることから、LipiDye®-MはTAGに変換され、脂肪滴に取り込まれていることが示唆される。TAG合成酵素であるDGAT1の阻害物質で処理すると、30分後において脂肪滴由来の赤色シグナルは顕著に抑制され、小胞体(ER)などのオルガネラ膜由来の黄色シグナルが強く観察された。この結果は、LipiDye®-MはDAGまで変換されても、TAGには変換されず、ERなどのオルガネラ膜に留まっていることを示唆している。
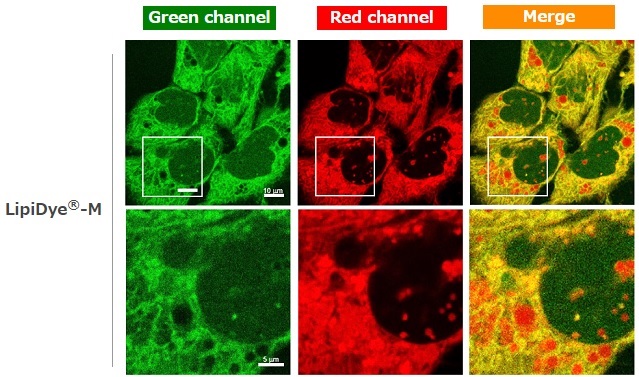
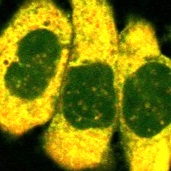
HepG2細胞におけるLipiDye®-M取り込み例
共焦点レーザー顕微鏡によるLipiDye®-Mの細胞内局在性の観察
図をクリックすると拡大します( )
)
HepG2細胞の脂肪滴産生を促すためオレイン酸およびパルミチン酸を含む10% FBS条件下で培養した。培地をHBSSに交換し、飢餓条件下にてLipiDye®-M(5 μM)で60分間処理した後、無洗浄条件下で共焦点レーザー顕微鏡を用いて観察を行った(Green channel Ex 473 nm / Em 490~540 nm、Red channel Ex 559 nm / Em 570~620 nm)。飢餓条件下ではLipiDye®-MはHepG2細胞の細胞質(緑色)、ER(黄色)、脂肪滴(赤色)に加え、ミトコンドリア(黄色)からも観察された。
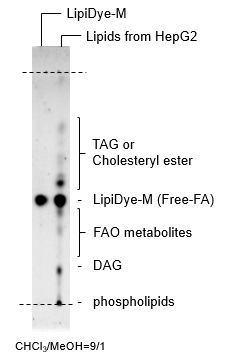
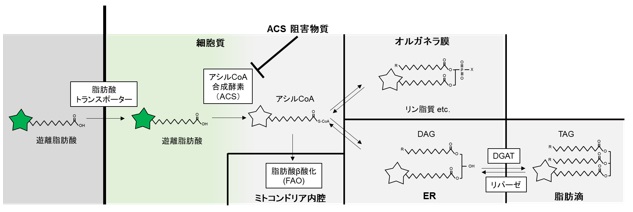
TLCによるLipiDye®-Mの細胞内での代謝変換の解析
薬剤処理による脂質代謝の変化
| Merge | |||
| LipiDye®-M | Control | ||
| +ACS inhibitor |
|||
| +DGAT1 inhibitor |
|||
図をクリックすると拡大します( )
)
HepG2細胞をあらかじめアシルCoA合成酵素(ACS)阻害物質(Triacsin C)またはTAG合成酵素DGAT1阻害物質(T863)を含む完全培地中で18時間処理し、各代謝経路を阻害した(右図)。その後、脂肪滴産生を促進するためオレイン酸(0.5 mM)、各阻害物質およびLipiDye®-M(5 μM)を含むHBSS培地で飢餓条件下にて6時間処理し、無洗浄条件下で共焦点レーザー顕微鏡(Green channel Ex 473 nm / Em 490~540 nm、Red channel Ex 559nm / Em 570~620 nm)を用いて観察した。コントロールでは脂肪滴の赤色シグナルが強く観察されたのに対し、ACS阻害物質処理細胞では脂肪滴の赤色シグナルおよびオルガネラ膜の黄色シグナルは弱く、緑色シグナルが優位に観察された。また、DGAT1阻害物質処理細胞では脂肪滴由来の赤色シグナルはほとんど見られず、オルガネラ膜の黄色シグナルが顕著に増強していることが観察された。ACS阻害物質によりLipiDye®-Mは遊離脂肪酸からアシルCoAに変換できず、遊離脂肪酸のまま留まっていることを示している。また、DGAT1阻害物質によりDAGからTAGへの変換が阻害され、脂肪滴に移行できずにERなどのオルガネラ膜に蓄積していることを示している。このように、薬剤処理時のLipiDye®-Mの局在と蛍光色を評価することで、薬剤が脂質代謝のどの過程に関与しているかを評価することができる。
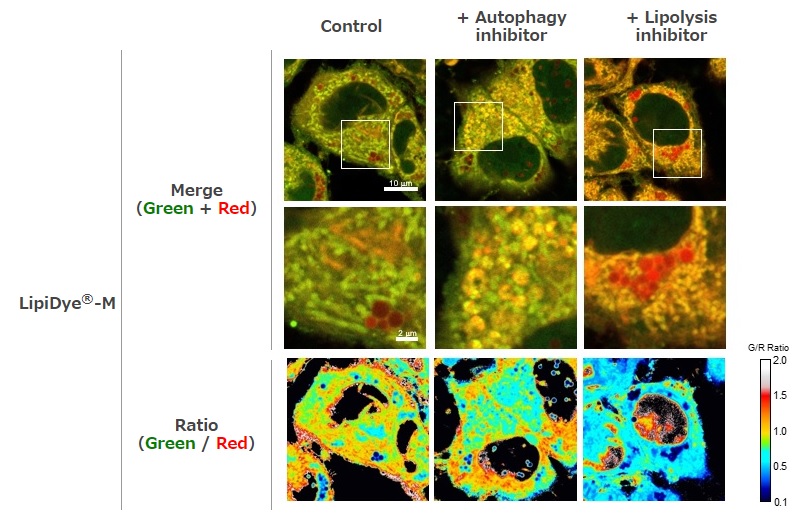
脂質分解経路阻害物質の効果
図をクリックすると拡大します( )
)
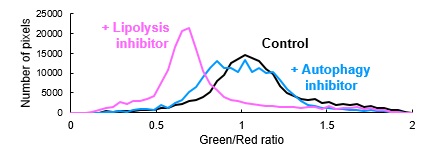
HepG2細胞をオートファジー阻害物質(50 nM Bafilomycin A1;オートファゴソーム‐リソソーム膜融合阻害物質)または脂肪分解阻害物質(100 μM DEUP)およびLipiDye®-M(5 μM)を含むHBSS培地で6時間処理した後、LipiDye®-Mの脂質代謝状態を共焦点レーザー顕微鏡(Green channel Ex 473 nm / Em 490~540 nm、Red channel Ex 559 nm / Em 570~620 nm)で観察し、重ね合わせ画像およびレシオ解析画像を取得した。コントロール条件下では、重ね合わせ解析像においてLipiDye®-Mはミトコンドリア(緑色)および脂肪滴(赤色)で主に観察されていたが、オートファジー阻害物質処理すると重ね合わせ画像において小胞様構造(オートファゴソーム)の膜が黄色で検出されており、オートファジーによる脂質分解が抑制されていることがわかる。また、脂肪分解阻害物質処理により、重ね合わせ画像において全体的に赤色蛍光が強まっており、LipiDye®-Mは脂肪滴およびオルガネラ膜に蓄積していることがわかる。
※ 詳しいレシオ解析方法については☞ 原著論文をご参照下さい。
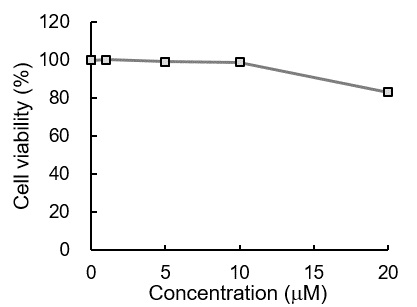
細胞毒性
追加しました。
原著論文
Kajiwara, K., et al., "A negative-solvatochromic fluorescent probe for visualizing intracellular distributions of fatty acid metabolites.", Nat. Commun., 13(1), 2533 (2022). [PMID:35534485]
追加しました。
価格
[在庫・価格 :2026年02月23日 09時15分現在]
| 詳細 | 商品名 |
|
文献数 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
LipiDye-M <Lipid Metabolism Tracer> |
|
0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
[在庫・価格 :2026年02月23日 09時15分現在]
LipiDye-M <Lipid Metabolism Tracer>
文献数: 0
- 商品コード:FDV-0028
- メーカー:FNA
- 包装:0.1mg
- 価格:¥60,000
- 在庫:3個以上
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | 環境応答性蛍光色素で標識された蛍光標識脂肪酸で,脂質の代謝状態とその周辺環境によって蛍光色が大きく変わるため,脂肪酸の代謝過程を緑色・黄色・赤色蛍光で追跡することができる。 |
||
|---|---|---|---|
| 法規制等 | |||
| 保存条件 | -20℃ | 法規備考 | |
| 掲載カタログ |
ニュース2024年2月1日号 p.4 ニュース2024年9月15日号 p.11 ニュース2022年10月1日号 p.6
|
||
| 製品記事 | 細胞内脂質代謝のイメージング試薬特集 フードサイエンス研究用製品特集 |
||
| 関連記事 | |||
追加しました。
おすすめ製品記事
-
フナコシ株式会社
/ 生細胞を用いた脂肪滴の長時間イメージングに有用です!
LipiDye®Ⅱ -
フナコシ株式会社
/ 生体膜や細胞内の脂質の状態を"見える化"します!
細胞内脂質代謝のイメージング試薬特集
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。