HOME
>
試薬
>
ELISA
>
ELISA/EIAキット
>
Quantikine ELISA Kit
HOME
>
試薬
>
サイトカイン/増殖因子/ホルモン
>
サイトカイン/増殖因子
>
サイトカインアッセイキット
>
Quantikine ELISA Kit
構築済みのELISA Kit Quantikine ELISA Kit
掲載日情報:2020/05/27 現在Webページ番号:81003
Quantikine ELISA Kit は、組織培養液、血清、血漿、尿、髄液などの様々な試料中(キットにより適合した試料は異なります)の天然型組換え型サイトカインやケモカイン、成長因子、プロテアーゼなどを迅速かつ正確に定量できます。
※ Quantikine ELISA Kitの簡易日本語マニュアルを配布中です。対象製品は日本語マニュアル配布中!をご覧下さい。
※ 本製品は研究用です。研究用以外には使用できません。

追加しました。
- 特長
- ELISAキット検索
- 品質について
- アッセイ手順(参考)
- 参考動画(日本語字幕付き)
- R&D Systems(R&Dシステムズ) Quantikine Kit 操作マニュアル
- 添加回収試験(Spike and Recovery Test)
- プロトコル例
- R&D SystemsのELISAトラブルシューティングガイド
特長
- サイトカインに対する捕捉用抗体と、検出用 HRP (horseradish peroxidase)標識抗体を用いるサンドイッチ法です。
- アッセイに必要なすべての試薬が含まれ、約 4.5 ~ 5.5 時間で結果が得られます。
- 他のサイトカインなどの存在下でも、目的物質を特異的に定量できます。
追加しました。
ELISAキット検索
※キーワード欄に何らかの因子名をご入力下さい。候補が表示されますので選択し、検索ボタンを押して下さい。
※製品がヒットしない場合、種交差性、感度、測定試料を「指定しない」に変更して再度ご検索下さい。
| キーワード | ||
|---|---|---|
| 種交差性 | 感度 | 測定試料 |
追加しました。
品質について
■ 低いロット間差
■ 特異性の検証
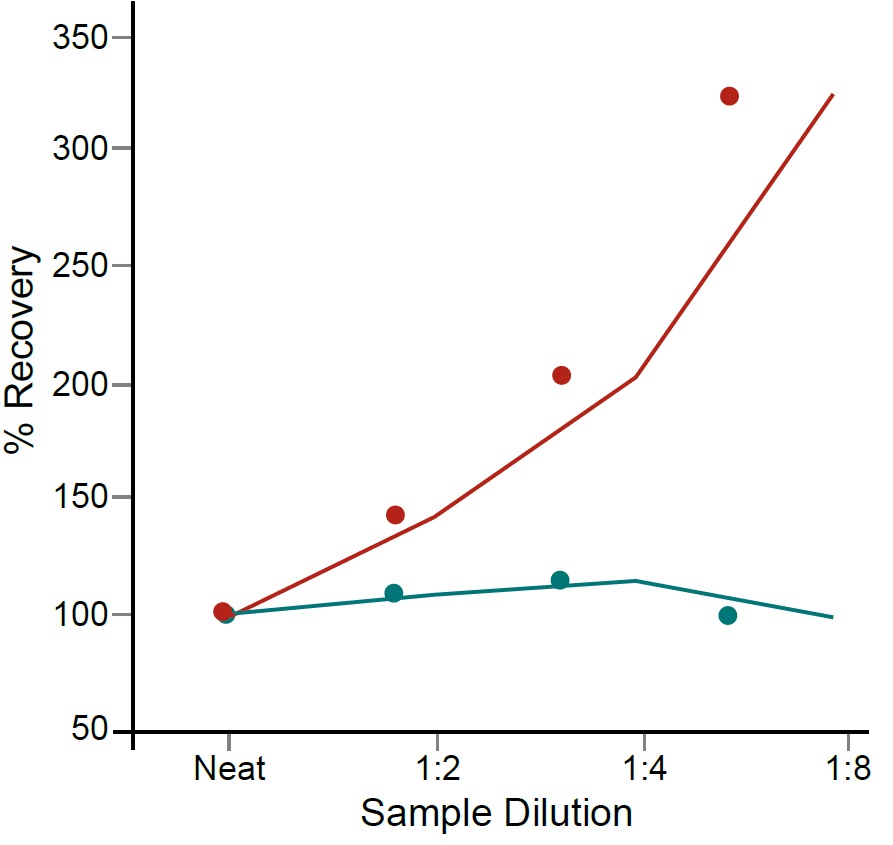
■ 希釈直線性の検証

⇒更に詳しい品質についてはこちら。
追加しました。
アッセイ手順(参考)
追加しました。
参考動画(日本語字幕付き)
追加しました。
R&D Systems(R&Dシステムズ) Quantikine Kit 操作マニュアル
R&D Systems(R&Dシステムズ)社 Human VEGF Quantikine ELISA Kit(#DVE00)の操作方法概略です。一般的なELISA キットの操作の参考にして下さい。
※ご注意
ご使用前に必ず各製品添付のデータシートをご覧の上、その指示に従って下さい。
キット内容
- VEGF microplate(捕捉用抗VEGF 抗体がコートされた96well マイクロストリッププレート)
- VEGF conjugate(HRP 標識検出用抗VEGF 抗体)
- VEGF standard(VEGF スタンダード)
- Assay diluent RD1W(測定用バッファー)
- Calibrator diluent RD5K( 細胞培養上清試料用希釈バッファー)
- Calibrator diluent RD6U(血清・血漿試料用希釈バッファー)
- Wash buffer concentrate(洗浄用バッファー)
- Color reagent A(安定化させたH2O2 )
- Color reagent B(TMB:HRP の基質)
- Stop solution(反応停止液)
- Plate sealer(プレートシーラー)
準備する物
- マイクロプレートリーダー(450 nm で吸光度を測定可能な物。 補正波長の540 または570 nm が測定できる物がよい。)
- ピペット、ピペットチップ
- 蒸留水
- プレートウォッシャーまたは、プレート洗浄用ボトル
- 500 ml シリンダー
- ポリプロピレンチューブ(12 mm × 75 mm)
- 測定試料
- Human VEGF コントロール(別売品:必要に応じて)
…など
測定可能試料および調製法
- 細胞培養上清(VEGF の安定化のために、少なくとも1%のfetal calf serum を加えて下さい。)
- 血清
- 血漿(抗凝血剤としてEDTA、クエン酸、ヘパリンのいずれかで処理した試料)
※ 詳細は製品添付のデータシートの「SAMPLE COLLECTION &STORAGE」の項目をご覧下さい。
試薬の調製
※ 使用する前に試薬はすべて室温に戻して下さい。
洗浄用バッファー :バッファー中に沈殿物が生じている場合は室温に戻し、よく混合して下さい。その後、最終容量が500 mになるように480 ml の蒸留水を加えて20 ml のWash buffer concentrate を希釈して下さい。
基質溶液 :使用する15 分前にColor reagent A・B を等量ずつ混合して下さい。各ウェルに200 μ l ずつ必要です。混合後は必ず遮光して下さい。
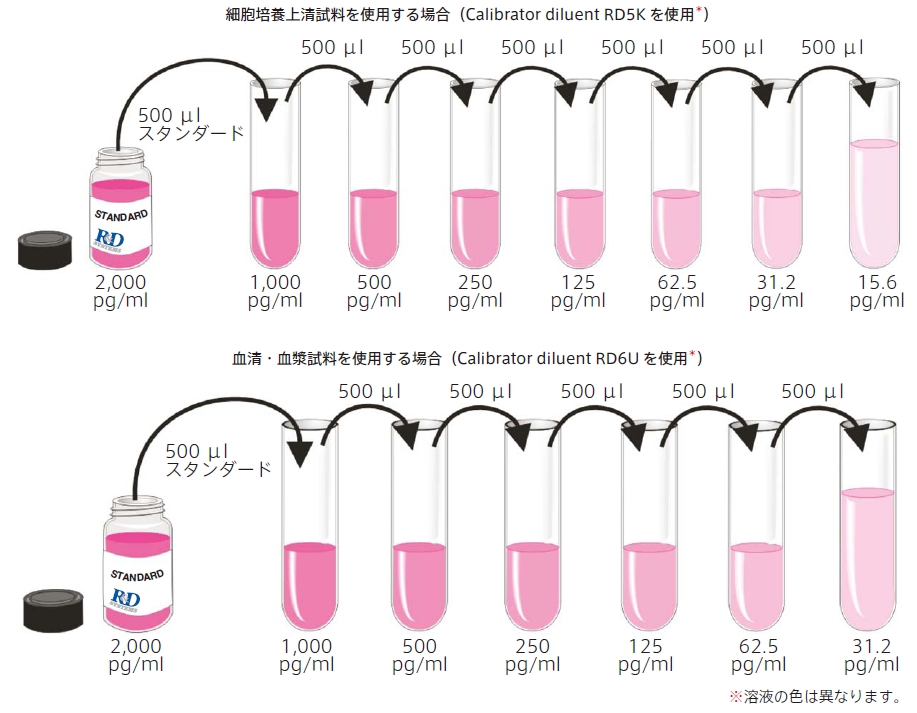
VEGF スタンダード :測定する試料(因子)によって希釈に使用するCalibrator diluent が異なります。添付のプロトコルをご覧下さい。希釈前に、15 分間穏やかに撹拌して下さい。
※ スタンダードを調製する際は、ポリプロピレンチューブ(12mm × 75 mm)をご使用下さい。
スタンダードの調製法
* Calibrator diluent はあらかじめ500 μ l ずつ各チューブに分注して下さい。
操作時の注意点
- すべての試料、スタンダードおよびコントロールは二重試験法でアッセイして下さい。
- タンパク質を含む試薬を取扱う際には、気泡を立てないようにして下さい。
- クロスコンタミネーションを避けるために、ピペットチップやリザーバーは試薬ごとに変えて下さい。
- インキュベーション中は必ずプレートシーラーでふたをして下さい。
- プレートウォッシャーを使用してプレート洗浄を行う場合には、プレートを30 秒間洗浄液にソークし、次の洗浄を行う前にプレートの左右の向きを入れ替えて下さい。
- 基質溶液は使用する15 分前に調製して下さい。調製後は必ず遮光して下さい。調製直後は青色ですが、ウェルに添加後、反応停止液を添加すると黄色に変化します。
- 基質溶液、反応停止液をウェルに添加した際に、ウェル中の溶液が緑色になってしまった場合は、プレートを軽くゆすって試薬を混合して下さい。
アッセイ方法
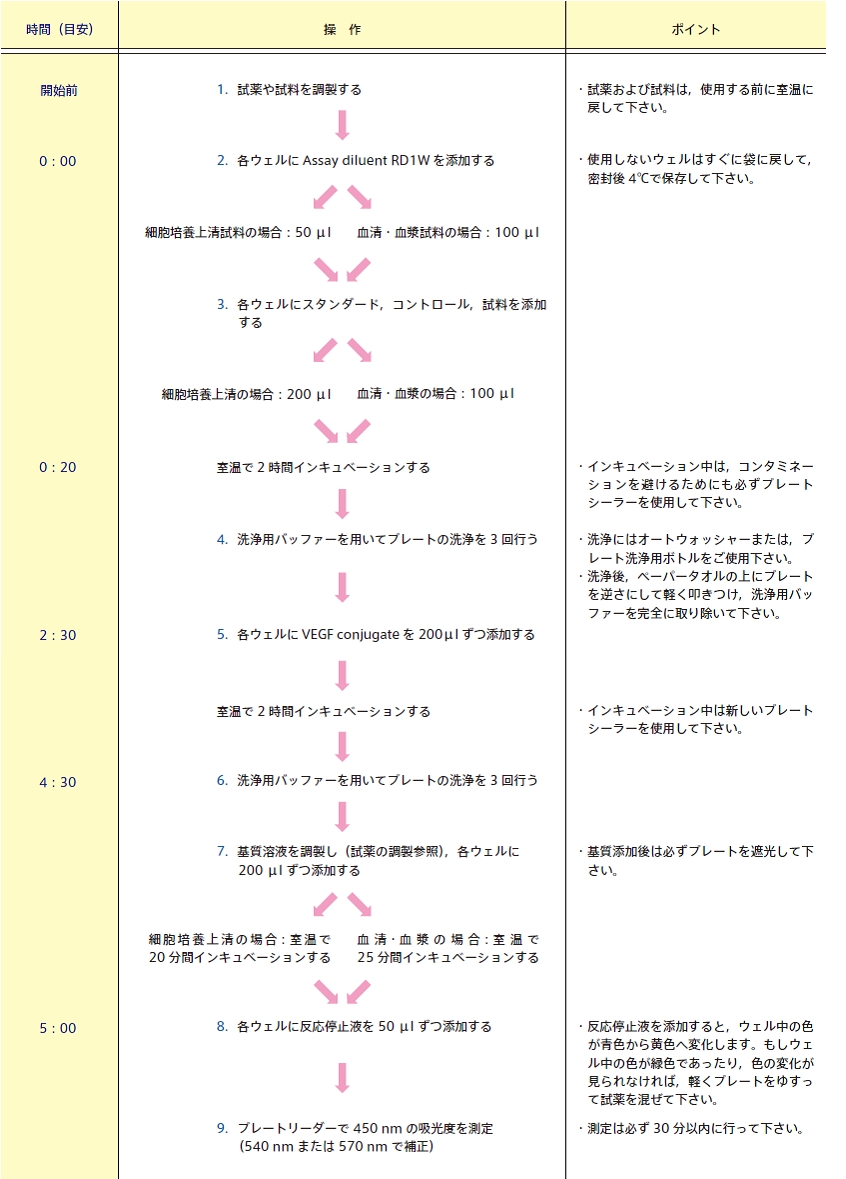
追加しました。
添加回収試験(Spike and Recovery Test)
適用試料と適用外試料について
ELISA は、対象因子を特異的に認識する抗体を用いて、試料中の対象因子を相対定量する測定法です。しかし、試料中または希釈溶液中に含まれる測定干渉物質(BSA、補体、異好性抗体、リウマチ因子など)により、抗原抗体反応が阻害され、測定精度に影響を及ぼし、実際の対象因子の含有量と測定値との間に“ずれ”が生じることがあります。
R&D Systems(R&Dシステムズ)社(以下RSD 社)では、各ELISA キットについて、測定干渉物質による“ずれ”が生じないことを確認するために、「添加回収試験(Spike and Recovery Test)」ならびに「直線性試験(Linearity Test)」を実施しています。両試験を実施し、測定に問題がないことが確認されている試料を「適用試料」、それ以外の試料を「適用外試料」としています。
適用外試料を用いて測定を行いたい場合、測定を開始する前に、お客様ご自身で添加回収試験と直線性試験を実施し、ご使用になるキットがその試料の測定に適しているかどうかを確認する必要があります。
添加回収試験(Spike and Recovery Test):
試料溶液に濃度既知の対象因子を添加(Spike)し、その添加量が測定値に正しく反映されるか(回収(Recovery))を確認する試験です。試料に含まれる成分による干渉の有無がわかります。
直線性試験(Linearity Test):
濃度既知の対象因子を添加した試料と添加しなかった試料で希釈系列を作製・測定し、直線性(Lineality)を確認する試験です。測定値が直線性を示さなかった場合には、試料に含まれる成分の干渉により、正確な測定が妨げられていることがわかります。さらに、直線性を示す希釈範囲を決定することも重要です。
本項では添加回収試験と直線性試験のプロトコル例をご紹介します。
追加しました。
プロトコル例
I.試験に必要なもの
- ELISA キット
- ELISA に必要な器具(製品添付のデータシート参照)
- 10 × Spiking Stock Solution(下記調製方法参照)
- 試料2.0 ml(キットの標準曲線範囲内の濃度のもの)*1
*1 標準曲線範囲に収まるよう、希釈して使用。
II.Spiking Stock Solution の調製
キット付属のスタンダードに、ELISA キットのプロトコル上でスタンダード調製の際に指定されている量の1/10 量の希釈溶液*2を加え、10 × Spiking Stock Soluion とします。
例) ELISA キットのプロトコル上で「Calibirator Diluent を5 ml 加えて200 pg/ml のスタンダードストック溶液とする。」と記載されている場合。
→ Calibirator Diluent を0.5 ml 加えて2 ng/ml の10 × Spiking Stock Solution とする。
III.スタンダードの調製
10 × Spiking Stock Solution に適切な希釈溶液*2を加えて10 倍希釈後、キット付属のプロトコルに従い、スタンダードの系列希釈を行う。
*2 Spiking Stock Solution の調製と希釈に用いる溶液は、ELISA キットのプロトコルを参照し、適切なものを使用して下さい。
IV.試料およびコントロールの調製
以下の手順に従って、試料(添加なし/あり)とコントロール(添加あり)を調製して下さい。
1. チューブを3 本用意し、それぞれに「試料(添加なし)」、「試料(添加あり)」、「コントロール(添加あり)」と書いたラベルを貼る。
2. 試料(2.0 ml)を良く混合し、下記のように加える。
(a):「試料(添加なし)」チューブに試料を1.0 ml 加える。→このまま測定に使用する。
(b):「試料(添加あり)」チューブに試料を1.0 ml 加える。
3. 「 コントロール(添加あり)」のチューブに希釈溶液* 2 を1.0 ml 加える(c)。
4. 新たにチューブを用意し、「試料(添加あり)」、「コントロール(添加あり)」に10 × Spiking Stock Solution をそれぞれ同量添加して測定用試料を調製する*3。10 × Spiking Stock Solution 由来の標準物質の濃度が、標準曲線の中間程度の値になるよう添加量を調節する。最終容量が二重測定に十分な量になるよう調節する。
例) (d):「試料(添加あり)」980 μ l に10 × Spiking Stock Solution を20 μ l 添加する。
(e):「コントロール(添加あり)」980 μ l に10 × Spiking Stock Solution を20 μ l 添加する。
5. 調製した試料およびコントロールをボルテックスで混合する。
*2 Spiking Stock Solution の調製と希釈に用いる溶液は、ELISA キットのプロトコルを参照し、適切なものを使用して下さい。
*3 調製は、同じピペットを用いて同時に行う必要がありますが、ピペットチップはその都度交換して下さい。
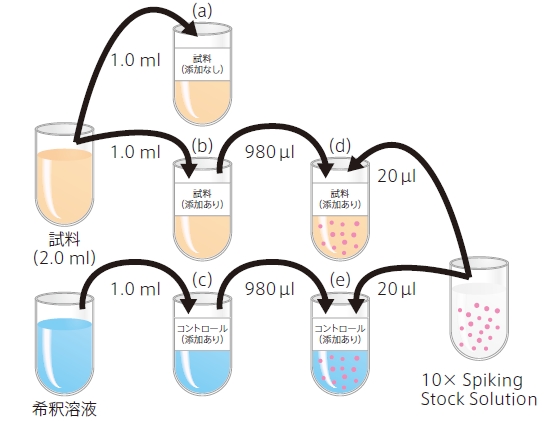
V. 添加した試料/コントロールの希釈系列作製(直線性試験)
直線性試験を行うため、(d)「試料(添加あり)」と(e)「コントロール(添加あり)」の希釈系列を作製します。(a)「試料(添加なし)」の濃度がスタンダードの最高濃度の60%を超えている場合には、同様に希釈系列を作製して測定を行って下さい。
系列希釈した試料の測定値が、キットの標準曲線と同様の傾きを示すかどうかを確認することで、試料を希釈しても測定値の正確性が保たれるかを判断できます。
1. 1:2 希釈
(a)「試料(添加なし)」、(d)「試料(添加あり)」、(e)「コントロール(添加あり)」それぞれ0.5 ml に希釈溶液0.5 ml を加える。
2. 1:4 希釈
上記の1:2 希釈した各試料溶液0.5 ml にさらに希釈溶液0.5 ml を加える。
3. 1:8 希釈
上記の1:4 希釈した各試料溶液0.5 ml にさらに希釈溶液0.5 ml を加える。
※ 希釈するたびにボルテックスで混合して下さい。
VI. アッセイの実施
キット付属のプロトコルに従い、III、IV、Vで調製した試料を用いてアッセイを行います。
プレートのウェル配置図
| 1 | 2 | 3 | 4 | 5 | 6 | |
| A | スタンダード 1 | 試料(添加あり) | コントロール( 添加あり) | |||
| B | スタンダード 2 | 1:2 希釈の試料(添加あり) | 1:2 希釈のコントロール( 添加あり) | |||
| C | スタンダード 3 | 1:4 希釈の試料(添加あり) | 1:4 希釈のコントロール( 添加あり) | |||
| D | スタンダード 4 | 1:8 希釈の試料(添加あり) | 1:8 希釈のコントロール( 添加あり) | |||
| E | スタンダード 5 | 試料(添加なし) | ||||
| F | スタンダード 6 | 1:2 希釈の試料(添加なし) | ||||
| G | スタンダード 7 | 1:4 希釈の試料(添加なし) | ||||
| H | ブランク | 1:8 希釈の試料(添加なし) | ||||
VII. 測定値の算出・解析
以下の計算式を使用して、測定値を算出し、解析を行います。
1. 添加回収試験
| 回収率(% Recovery)= | 「試料(添加あり)」の測定値 -「 試料(添加なし)」の測定値 | ×100 |
| 添加した標準物質の量 |
2. 直線性試験
・「 試料(添加あり)」の直線性を検討する場合、「試料(添加あり)」の測定値を「予測値」とする。
・「 試料(添加なし)」の直線性を検討する場合、「試料(添加なし)」の測定値を「予測値」とする。
| 1:2 希釈の回収率(%)= | 1:2 希釈試料の測定値 | ×100 |
| 予測値÷2 |
| 1:4 希釈の回収率(%)= | 1:4 希釈試料の測定値 | ×100 |
| 予測値÷4 |
| 1:8 希釈の回収率(%)= | 1:8 希釈試料の測定値 | ×100 |
| 予測値÷8 |
※ 回収率80 ~ 120%が許容範囲です。
※「 コントロール(添加あり)」は希釈系列が正しく作製できているかの確認に使用します。「コントロール(添加あり)」の回収率が80 ~120%にならない場合は、調製方法に問題があると考えられます。
VIII. 結論
添加回収試験および直線性試験の測定値が適切な範囲内に収まっていれば、条件未検討の適用外試料にELISA キットを使用する際の信頼度が向上します。
追加しました。
R&D SystemsのELISAトラブルシューティングガイド
- 精度が低い
- 標準曲線が描けない
- 標準曲線のOD 値が全体的に低い。または、標準曲線の傾きが小さい
- 十分なシグナル強度が得られない
- バックグラウンドが高い
- 測定の再現性が悪い
- 試料中に測定物質が検出されない
- 試料の吸光度が標準曲線の測定範囲を超えてしまった
- プレートすべてのウェルで吸光度が低い
- プレートすべてのウェルで吸光度が高い
- 誤差
Q-1 精度が低い
- A-1
- ウェルの洗浄が不十分
・プレートウォッシャーを使用している場合、洗浄装置が正常に作動するか確認して下さい。
・ 洗浄の回数や時間を省略しないで下さい。 - アスピレーションが不十分
・アスピレーション後、ウェル内に溶液が残っていないことを確認して下さい。 - 洗浄の液量が不十分
・プロトコルで指示されている液量を守ってください。 - 試薬の混合が不十分
・試薬や試料は使用前によく混合して下さい。ウェル内の試薬も十分に混合して下さい。 - 試薬容量が不均一
・ピペットの性能をチェックし、必要に応じて較正を行って下さい。
・ピペットチップがきちんと装着されているか確認して下さい。 - ウェルが乾燥してしまっている
・試薬の添加は迅速に行って下さい。 - ピペットチップなどを再利用している
・ピペットチップはスタンダード、試料、試薬ごとに交換して下さい
・リザーバーは区画が分かれているものを使用するか、試薬ごとに交換して下さい。
・プレートカバーはインキュベーションごとに新しいものを使用して下さい。
- ウェルの洗浄が不十分
Q-2 標準曲線が描けない
- A-2
- スタンダード溶液の調製が間違っている
・スタンダードの希釈には専用の希釈溶液を使用して下さい。
・スタンダード溶液の種類、数が正しいか確認し、プロトコル記載の容量を守って希釈して下さい。 - ウェルの洗浄が不十分
・プレートウォッシャーを使用している場合、洗浄装置が正常に作動するか確認して下さい。
・プロトコル記載の洗浄回数や時間を守って下さい。 - アスピレーションが不十分
・アスピレーション後、ウェル内に溶液が残っていないことを確認して下さい。 - 試薬容量が不均一
ピペットの性能をチェックして、必要があれば再補正して下さい。
・ピペットの性能をチェックし、必要に応じて較正を行って下さい。
・ピペットチップがきちんと装着されているか確認して下さい。 - 基質の調製が早すぎる
調製するタイミングはプロトコル記載の手順に従って下さい。 - 読み取り時間をオーバーしている
プロトコル記載の読み取り時間内に測定して下さい。 - 換算方法が間違っている
・プロトコル記載の計算方法を用いて下さい(他の方法では正確な標準曲線が得られない場合があります)。
- スタンダード溶液の調製が間違っている
- A-3
- Streptavidin-HRP 濃度が低すぎる
・Streptavidin-HRP 溶液が正確に希釈されているか確認して下さい。必要ならば Streptavidin-HRP の濃度調節を行って下さい。 - 捕捉用抗体(Coating/Capture Antibody)がプレートに十分コートされていない
・ELISA 用プレートを使用して下さい(細胞培養用プレートは使用しないで下さい)。
・タンパク質を含まない PBS で捕捉用抗体を希釈して下さい。
・抗体が正確に希釈されているか確認して下さい。必要ならば抗体の濃度調節を行って下さい。 - 検出用抗体の濃度が低すぎる
・抗体が正確に希釈されているか確認して下さい。必要ならば抗体の濃度調節を行って下さい。 - 操作法が不適切
・キットのプロトコルに従い、再実験を行って下さい。
- Streptavidin-HRP 濃度が低すぎる
Q-4 十分なシグナル強度が得られない
- A-4
- ウェルに加える基質の液量が不十分
・ピペットの性能をチェックし、必要に応じて較正を行って下さい。
・ピペットチップがきちんと装着されているか確認して下さい。 - 基質の調製が間違っている
・基質の液量、調製方法が正しいか確認して下さい。
・十分に混合し、プロトコル記載の時間内に使用して下さい。 - インキュベーション時間/温度が間違っている 指示されている
・プロトコル記載のインキュベーション時間と温度で反応を行って下さい。
・周囲の温度変化の影響を受ける場所でのインキュベーションは避けて下さい。 - HRP /基質の不良
・Streptavidin-HRP とTMB 基質を等量混合して、発色することを確認して下さい。 - 読み取り時間をオーバーしている
・プロトコル記載の読み取り時間内に測定して下さい。 - 測定機器の設定が間違っている
・マイクロプレートリーダーが正しい波長で使用されているか確認して下さい。
・ルミノメーター設定が正しいか確認して下さい。 - 反応停止液を加えた後の混合が不十分
・反応停止液をウェルに加えた後、溶液が緑色を示している場合は混合不足です。 - 間違った試薬を使用している
・各ステップで用いる試薬が正しいか、もう一度確認して下さい。
- ウェルに加える基質の液量が不十分
Q-5 バックグラウンドが高い
- A-5
- ウェルの洗浄が不十分
・キットのプロトコルに従い、プレートを適切に洗浄して下さい。
・洗浄バッファーを加えた後、30 秒間保持してから、除去して下さい。
・洗浄回数を1 回増やして下さい。
プレートウォッシャ-を使用している場合:
・洗浄ポートに汚れやつまりがないか確認して下さい。
・洗浄バッファーを加えた後、30 秒間保持する行程をプログラムに追加して下さい。
・洗浄行程の途中でプレートの左右の方向を変えてみて下さい。 - プレートのブロッキングが不十分
・プレートのブロッキング条件とブロッキング試薬を確認して下さい。
- ウェルの洗浄が不十分
Q-6 測定の再現性が悪い
- A-6
- ウェルの洗浄が不十分
・キットのプロトコルに従い、プレートを適切に洗浄して下さい。
・洗浄バッファーを加えた後、30 秒間保持してから、除去して下さい。
・洗浄回数を1 回増やして下さい。
プレートウォッシャ-を使用している場合:
・洗浄ポートに汚れやつまりがないか確認して下さい。
・洗浄バッファーを加えた後、30 秒間保持する行程をプログラムに追加して下さい。
・洗浄行程の途中でプレートの左右の方向を変えてみて下さい。 - スタンダードや試料が均一ではない
・使用前にスタンダードや試料を十分混和して下さい。 - 血清・血漿サンプルの添加量が正確ではない
・プレートに試料を添加する前に、ピペットチップの先に付着している試料を十分拭き取って下さい。 - インキュベート時の温度条件がばらついている
・推奨反応温度を守って下さい。
・温度変化が激しい場所ではインキュベートを行わないで下さい。 - 測定ごとにプロトコルを改変している
・測定間でプロトコルの改変を行わないで下さい。 - バッファーが汚染されている
・バッファーを再度作製して下さい。
- ウェルの洗浄が不十分
Q-7 試料中に測定物質が検出されない
- A-7
- 試料中に測定物質が存在しない
・ポジティブコントロールを設定して下さい。
・実験条件や試料採取・保存方法等を確認して下さい。 - 試料中に測定妨害物質が存在する
・適切な試料希釈液を用いて、試料を希釈して下さい(最低でも3 倍希釈する)。可能であれば数段階の試料希釈列を作製し、測定を行って下さい。 - 試料が適切に保存されていなかった
・試料の保存条件・保存可能期間を確認して下さい。 - 試料が凍結融解を繰り返されていた
・試料の再凍結保存は行わないで下さい。
- 試料中に測定物質が存在しない
- A-8
- 試料中に測定物質が過剰に存在する
・試料を希釈し、再度測定して下さい。
- 試料中に測定物質が過剰に存在する
- A-9
- Streptavidin-HRP または TMB 基質が劣化している
・Streptavidin-HRP とTMB 基質を等量混合して、発色することを確認して下さい。 - Streptavidin-HRP の濃度が低すぎる
・抗体濃度を変更した場合には、Streptavidin-HRP 濃度も再調製して下さい。 - 捕捉用抗体または検出用抗体の濃度が低すぎる
・各抗体の希釈倍率がプロトコルに合っているか確認して下さい。 - プレートリーダーの測定波長が誤って設定されている
・プレートリーダーの測定波長を正しく設定して下さい。 - 発色反応が十分進んでいない
・TMB 基質との反応時間を延長して下さい。 - 捕捉用抗体をコートしたプレートが劣化している
・新たに捕捉用抗体をコートしたプレートを作製して下さい。 - 捕捉用抗体がプレートに十分コートされていない
・ELISA 用プレートを使用して下さい(細胞培養用プレートは使用しないで下さい)。
・タンパク質を含まない PBS で捕捉用抗体を希釈して下さい。 - プレートを洗浄後にウェルが乾燥してしまった
・プレートを洗浄後、速やかに次のステップに進んで下さい。 - ピペットチップ等でウェルを引っかいてしまった
・新しいウェルで再度測定を行って下さい。
- Streptavidin-HRP または TMB 基質が劣化している
- A-10
- TMB 基質が汚染している
・プレートに加える前に、TMB 基質が無色であることを確認して下さい。
- TMB 基質が汚染している
Q-11 誤差
- A-11
- アッセイの準備を断続的に行っている
・使用する試薬類はすべてアッセイを開始する前に準備して下さい。
・スタンダードや試料は20 分以内にプレートへ加えて下さい。 - ルミノメーターの設定が間違っている
・化学発光の測定は1.0 秒/ウェルで読み取りを行って下さい(2.0 秒以上で読み取りを行うと、最初のウェルから最後のウェルまで読み取る間に時間がかかり、誤差の原因となります)。 - インキュベーション時間/温度設定が間違っている
・プロトコル記載のインキュベーション時間と温度で反応を行って下さい。
・周囲の温度変化の影響を受ける場所でのインキュベーションは避けて下さい。 - 試薬の温度が室温になっていない
・プロトコル中で特に指示のない場合は、使用前にすべての試薬が室温状態にあるか確認して下さい。 - 測定場所の温度条件が一定でない(Edge effect が見られた)
・温度変化が激しい場所ではインキュベートを行わないで下さい。
・プレートシーラーを使用して下さい。
- アッセイの準備を断続的に行っている



追加しました。
おすすめ製品記事
-
R&D Systems, Inc.
/ サイトカイン測定ELISAキット
R&D Systems Quantikine ELISA Kit/DuoSet Kit特集 -
R&D Systems, Inc.
DuoSetに必要な別売品セット(DuoSet Ancillary Reagent Kit)/その他別売品 -
INTERSCIENCE
/ コロニーカウント作業時の負担を軽減!
マニュアル式コロニーカウンター Scan 50/Scan 50 pro -
R&D Systems(R&Dシステムズ)社 Quantikine Kit 操作マニュアル
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。