HOME
>
試薬
>
細胞情報伝達
>
リン酸化
>
SLIPT-PMのアプリケーション例
HOME
>
試薬
>
細胞情報伝達
>
Gタンパク質/環状ヌクレオチド
>
Gタンパク質(GPCR)関連商品
>
SLIPT-PMのアプリケーション例
実験モデルと実績結果をご紹介します SLIPT-PMのアプリケーション例
掲載日情報:2022/07/14 現在Webページ番号:70608

フナコシ /
フナコシ株式会社
[メーカー略称:FNA]
タンパク質の細胞膜局在誘導試薬SLIPT-PMについて、様々なシグナル経路におけるアプリケーション実績をご紹介します。
※ 本製品は名古屋工業大学の研究成果をもとにフナコシ(株)が製品化し、販売しています。
※「タンパク質の細胞膜局在誘導試薬 SLIPT-PM」の詳細はこちらをご覧下さい。
※ 本製品は研究用です。研究用以外には使用できません。
追加しました。
- アプリケーション例
- Raf-MEK-ERK経路の活性化
- Gαqシグナル経路の活性化
- Gαsシグナル経路の活性化
- RacGEF(Tiam1) - Racシグナル経路の活性化
- PI3K-Aktシグナル経路の活性化
- ドメイン置換Grb2様タンパク質によるRasシグナル経路の活性化
- 価格
アプリケーション例
下記のシグナル経路について、実験モデルと実績結果をご参照いただけます。
| 経路 | 活性化因子 | 下流因子 | 紹介ページ |
|---|---|---|---|
| Ras経路 | Raf | MEK-ERK | こちらをクリック |
| Grb2/SOS1 | Ras-Raf-MEK-ERK | こちらをクリック | |
| Gαq経路 | Gαq | PLCβ-PIP2-IP3 | こちらをクリック |
| Gαs経路 | Gαs | Adenylate cyclase-cAMP | こちらをクリック |
| RacGEF-Rac経路 | RacGEF(Tiam1) | Rac-actin | こちらをクリック |
| PI3K-Akt経路 | PI3K | PIP3-Akt | こちらをクリック |
追加しました。
Raf-MEK-ERK経路の活性化
①安定的な活性化モデル
■対象シグナル経路:cRaf → MEK → ERK
■使用したコンストラクト:
・iK6DHFR融合タンパク質:EGFP-iK6DHFR-cRaf*1 (addgene ID:172107)
・レポータータンパク質:核内ERK活性化評価センサータンパク質 ERKKTR-mKusabiraOrange (mKO) *2
*1 cRaf は全長タンパク質を使用
*2 ERKKTRはERKに対するkinase translocation reporter
■SLIPT-PM濃度:SLIPT-PM 10 μM
■使用した細胞:HeLa
■使用培地:DMEM(無血清培地)
■実験モデル:
cRafは低分子量GTPaseであるRasの下流因子で、Rasにより細胞膜上で活性化され、MEK-ERK経路を活性化する機能を有します。ERKはリン酸化されることで核内に移行し、転写因子のリン酸化を担います。
本実験ではSLIPT-PMシステムを利用し、EGFP-iK6DHFR-cRafをSLIPT-PMで直接活性化することで、Rasおよびその上流シグナル因子なしでcRafから下流のシグナル伝達を誘導します。アウトプットとして、核内ERK活性化評価センサータンパク質ERKKTR-mKOを利用し、定常状態で核内に発現するERKKTR-mKOが核内ERKによりリン酸化されると核外に移行することを指標として本経路の活性化を検出しました。
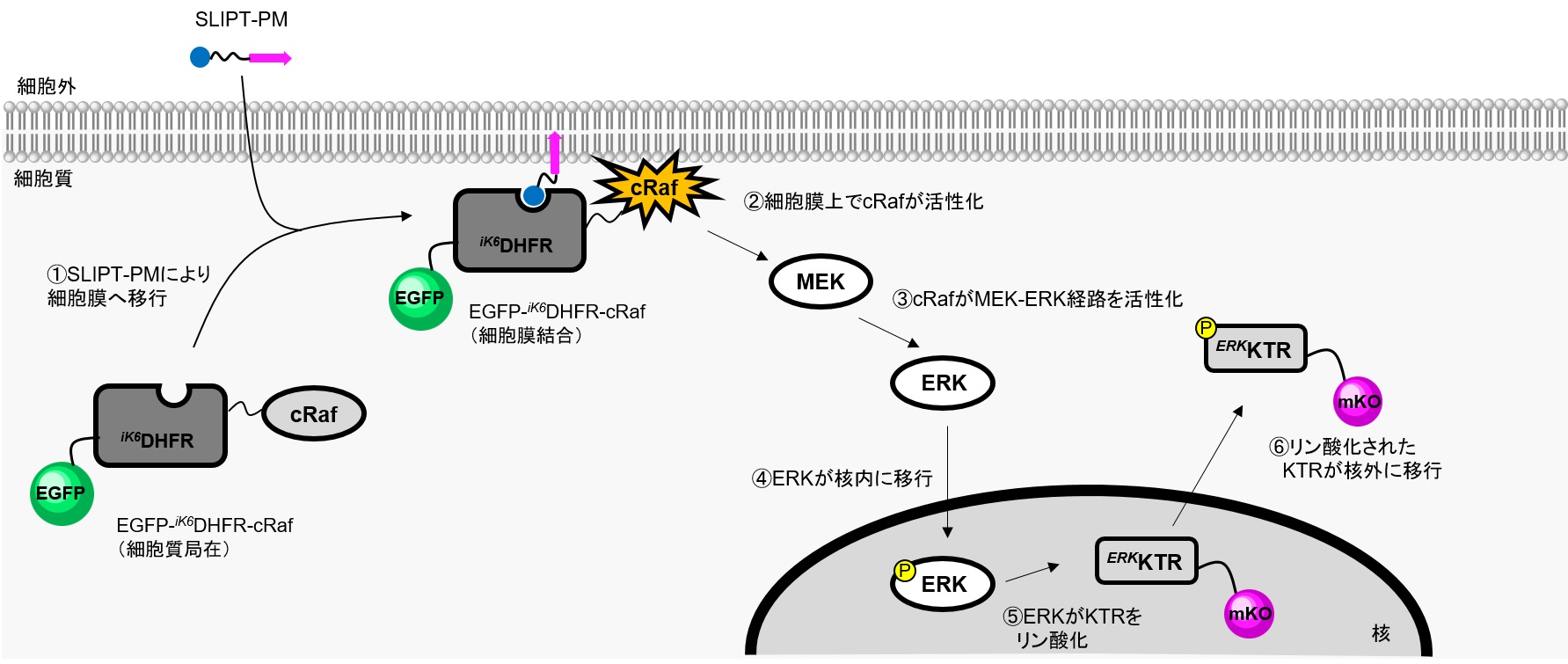
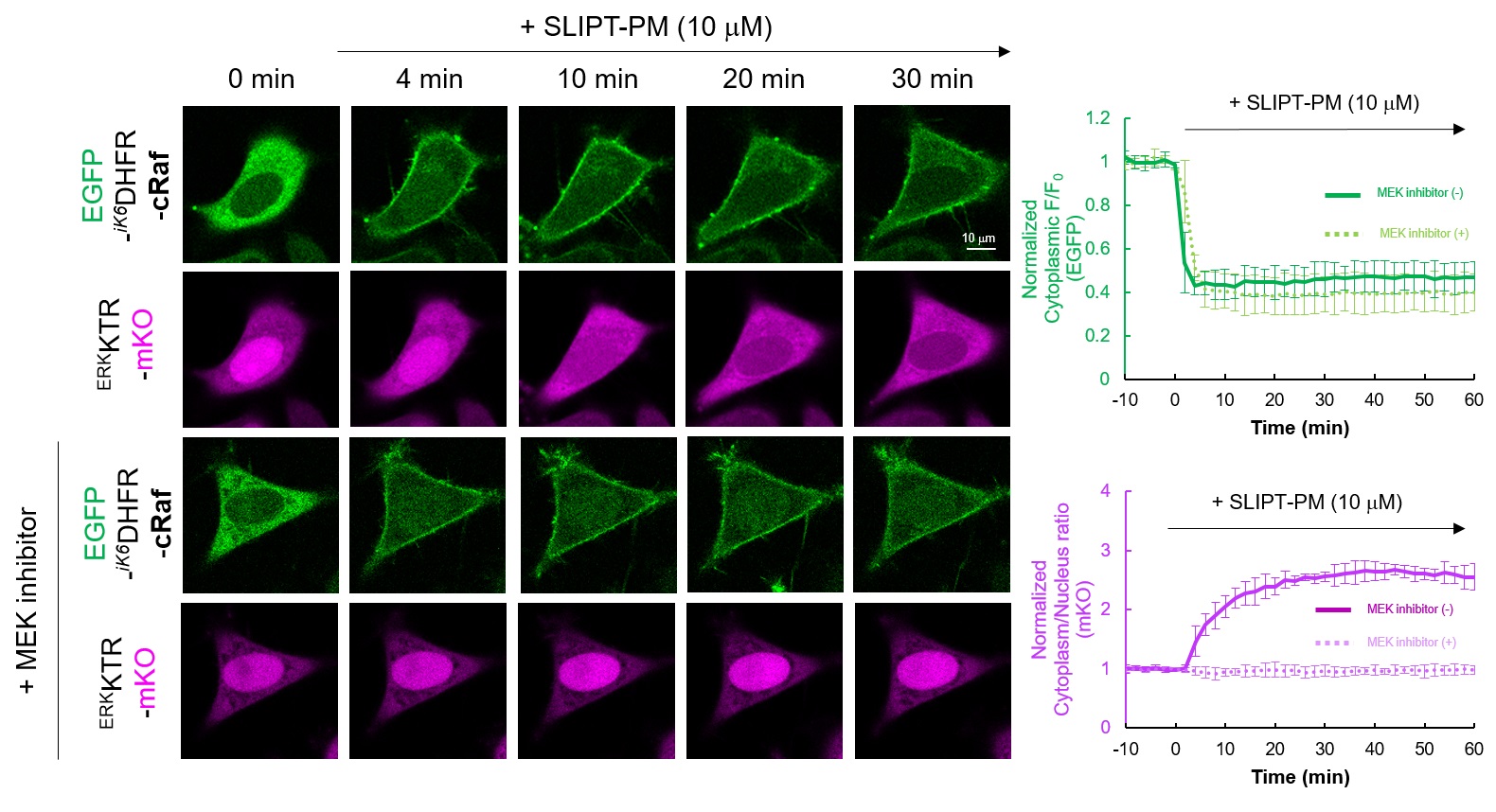
HeLa細胞でEGFP-iK6DHFR-cRafとERK活性化評価センサータンパク質ERKKTR-mKOを共発現させると、EGFP-iK6DHFR-cRafは細胞質、ERKKTR-mKOは核内にメインに局在している。そこにSLIPT-PMを10 μM添加するとEGFP-iK6DHFR-cRafが速やかに細胞膜に移行(t1/2~1 min)する様子が観察された。それに伴いERKKTR-mKOは核から細胞質に移行することが観察された。一方、MEK阻害物質を添加するとERKKTR-mKOの細胞質への移行は顕著に抑制された。この結果は、SLIPT-PMがEGFP-iK6DHFR-cRafの細胞膜移行を誘導し、cRafを起点とするMEK-ERKシグナル経路を活性化していることを示唆している。
②可逆的な繰り返し活性化モデル
■対象シグナル経路:cRaf → MEK → ERK
■使用したコンストラクト:
・iK6DHFR融合タンパク質:cRaf-mNeonGreen (mNG) -iK6DHFR(addgene ID:172107)
・レポータータンパク質: ERK核移行評価タンパク質 mCherry-ERK
■SLIPT-PM濃度:10 μM
■Free-TMP濃度:50 μM
■使用した細胞:HeLa
■使用培地:DMEM(無血清培地)
■実験モデル:
cRafは低分子量GTPaseであるRasの下流因子で、Rasにより細胞膜上で活性化され、MEK-ERK経路を活性化する機能を有します。MEKによりリン酸化されたERKは細胞質から核内に移行し、転写因子の活性化を担っています。
本実験ではSLIPT-PMシステムを利用し、cRaf-mNG-iK6DHFRをSLIPT-PMで細胞膜上に移行させることでcRafを活性化し、アウトプットとしてmCherry-ERKの核移行を観察します。その後、Free-TMPを追加で添加することにより、SLIPT-PMとFree-TMPが置き換わりcRaf-mNG-iK6DHFRの細胞膜局在が解消され、さらに洗浄操作でFree-TMPを除くことで細胞膜上に残存するSLIPT-PMによって再度cRaf-mNG-iK6DHFRが細胞膜上に移行して、MEK-ERKが活性化される様子を観察しています。
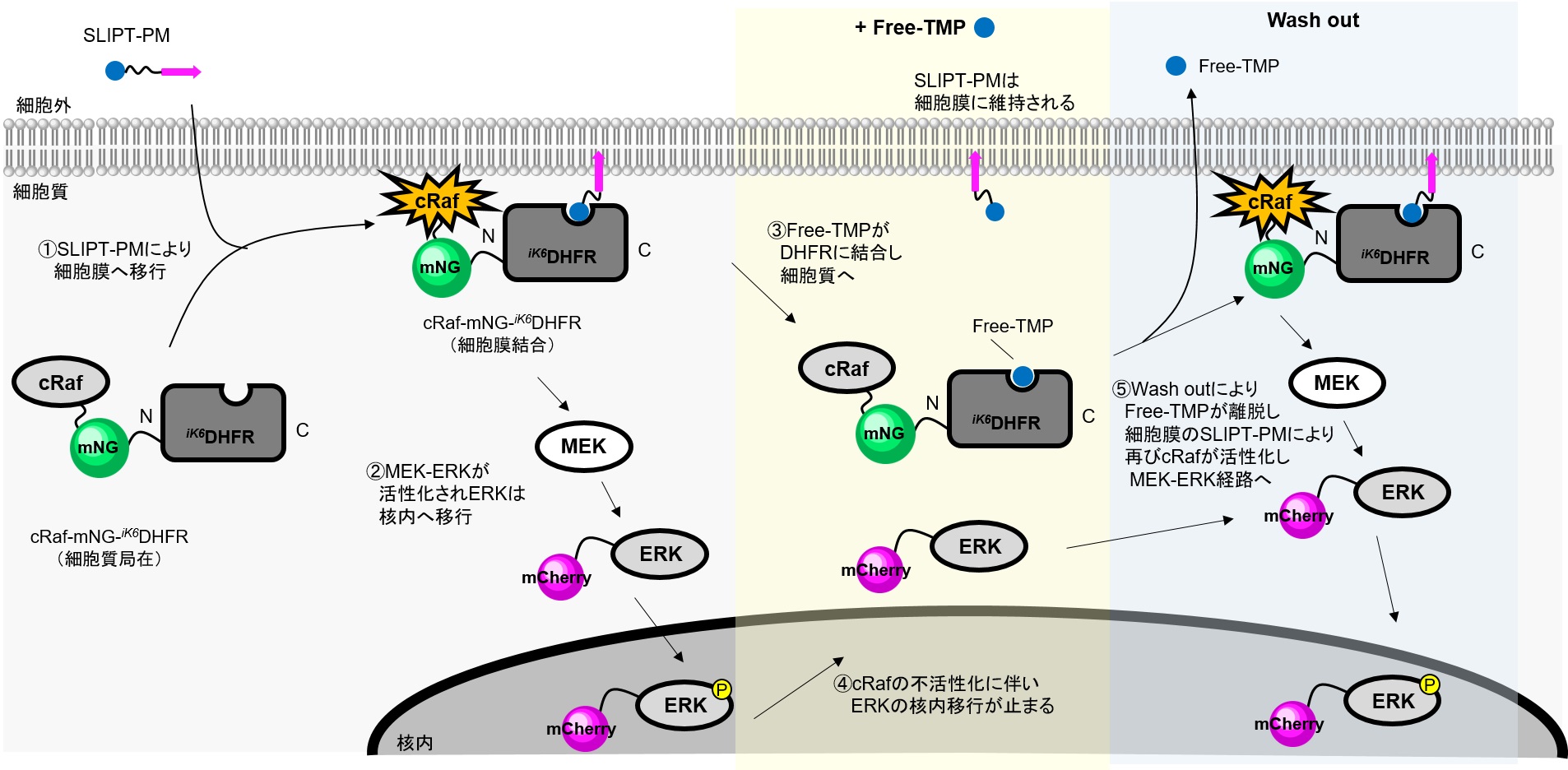
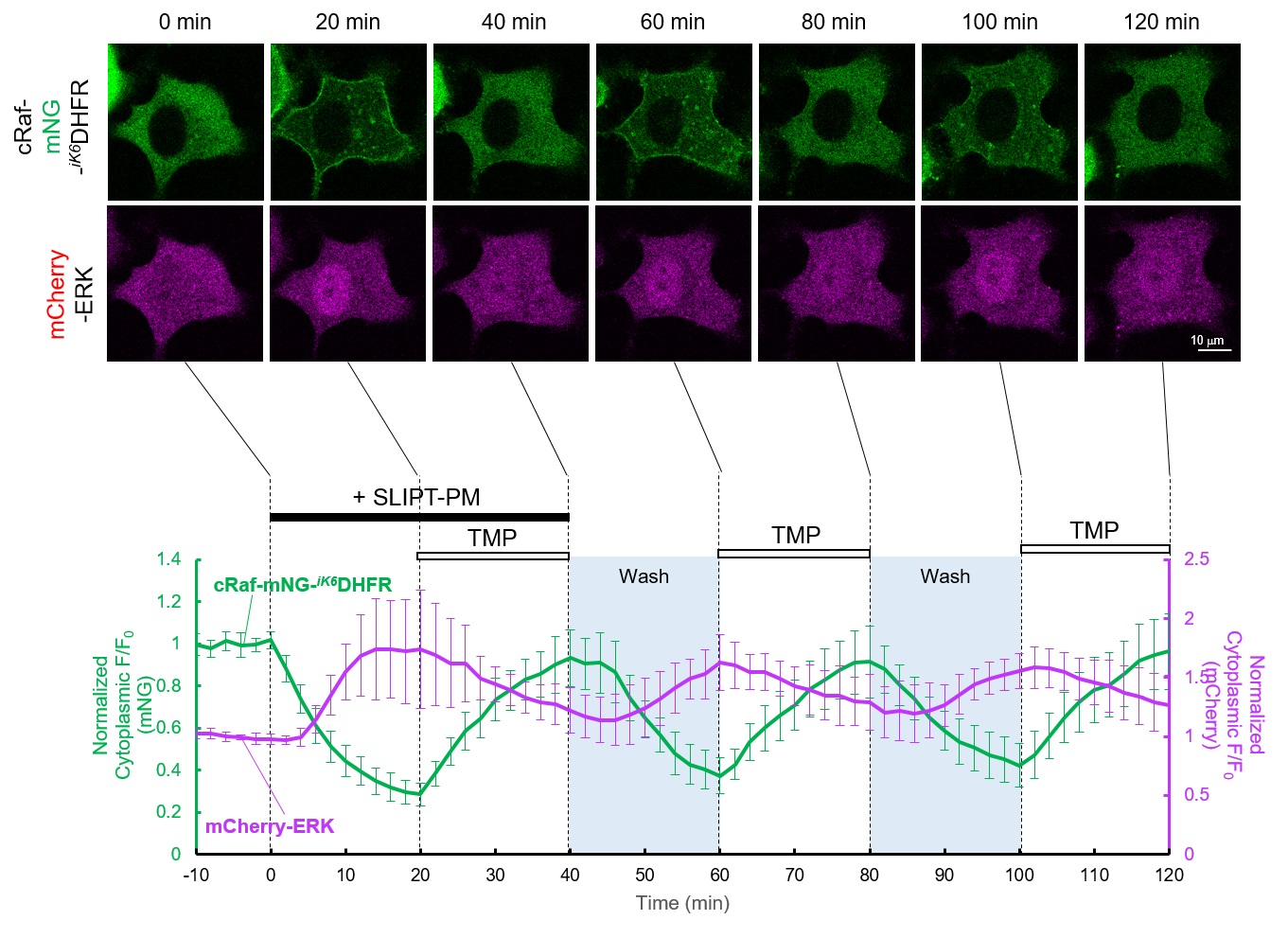
HeLa細胞でcRaf-mNG-iK6DHFRとERK核移行評価タンパク質mCherry-ERKを共発現させると、cRaf-mNG-iK6DHFR、mCherry-ERKはともに細胞質に局在が観察される。そこにSLIPT-PMを10 μM添加するとcRaf-mNG-iK6DHFRは細胞膜に移行(t1/2~7 min)する様子が観察された。それに伴いmCherry-ERKは細胞質から核に移行することが観察された。SLIPT-PM添加後20分でFree-TMP 50 μMを追加で添加すると、cRaf-mNG-iK6DHFRの細胞膜局在は解消され、mCherry-ERKの局在も緩やかに核から細胞質メインに変化した。その後20分間(40~60 min)ペリスタポンプを用いた流路による連続的培地交換を行い、余剰のFree-TMPを除去すると、SLIPT-PMを追加で添加しなくともcRaf-mNG-iK6DHFRは再び膜に局在し、mCherry-ERKの核移行が観察された。60 minにおいてFree-TMP(2回目)を添加すると1回目の添加時と同様にcRaf-mNG-iK6DHFRの細胞膜局在は解消され、mCherry-ERKが観察された。洗浄・Free-TMPの添加による可逆的な効果は少なくとも2回維持していた。この結果よりSLIPT-PMは一度添加することにより細胞膜に保持され、Free-TMPと洗浄操作を繰り返すことでiK6DHFR融合タンパク質を複数回可逆的に細胞膜上活性化・不活性化することが可能であることが示唆された。
スケールバー 10 μm
追加しました。
Gαqシグナル経路の活性化
■対象シグナル経路:Gαq → ホスホリパーゼL(PLCβ)→ PI(4,5)P2(PIP2)→ ジアシルグリセロール(DAG)+ イノシトール 1,4,5-トリスリン酸 (IP3)→ IP3レセプター型カルシウム放出チャネル → カルシウムイオンの細胞質放出 → カルシウム振動
■使用したコンストラクト:
・iK6DHFR融合タンパク質:mNeonGreen(mNG)-iK6DHFR-Gαq(addgene ID:172106)、mNeonGreen(mNG)-iK6DHFR-Gαq(L254A)(addgene ID:178851)
※ 本実験ではGαqはQ209L/C9S/C10S変異体、Gαq (L254A) はQ209L/C9S/C10S/L254A変異体を使用しています。
(Q209L:恒常的活性化変異、C9S/C10S:パルミトイル化修飾の欠損変異で自発的な細胞膜結合性を示さない、L254A:PLCβ結合部位を欠損した変異体でPLCβの活性化を誘導しない)
・レポータータンパク質:カルシウム応答性蛍光タンパク質 (R-GECO)
■SLIPTリガンドと濃度:SLIPT-PM 5 μM
■使用した細胞:HeLa
■使用培地:10 mM HEPES含有HBSS
■実験モデル:
GαqはGPCRに結合する三量体Gタンパク質αサブユニットの一つで、GPCRのリガンド結合により活性化しPLCβを活性化します。PLCβはPIP2をIP3とDAGに分解し、IP3は細胞膜から解離してER膜上に発現するカルシウム放出チャネルIP3レセプターに結合し、ER内からカルシウムイオンの細胞質放出を誘導します。細胞質のカルシウムイオン濃度が上昇すると負のフィードバック制御がかかり、カルシウム濃度が再び低下し、この繰り返しによりカルシウム濃度が定期的に振動変化する現象が知られています。
本実験ではSLIPT-PMシステムを利用し、下図のようにmNG-iK6DHFR-GαqをSLIPT-PMで細胞膜上に輸送することでGPCR刺激なしでもGαqから下流のシグナル伝達を誘導します。アウトプットとしてカルシウムイオン応答性蛍光タンパク質(以下、カルシウムセンサーと表記)を用いて、細胞質のカルシウム量を観察しています。
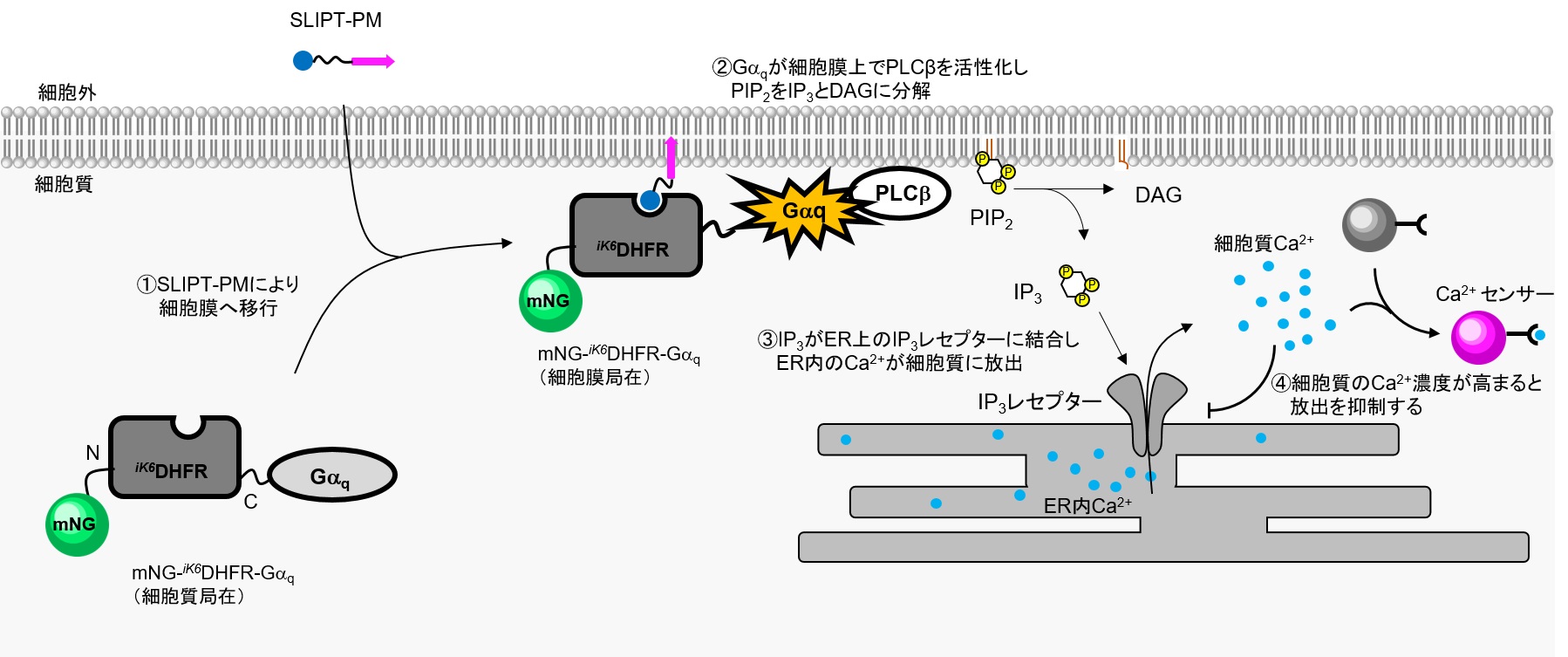
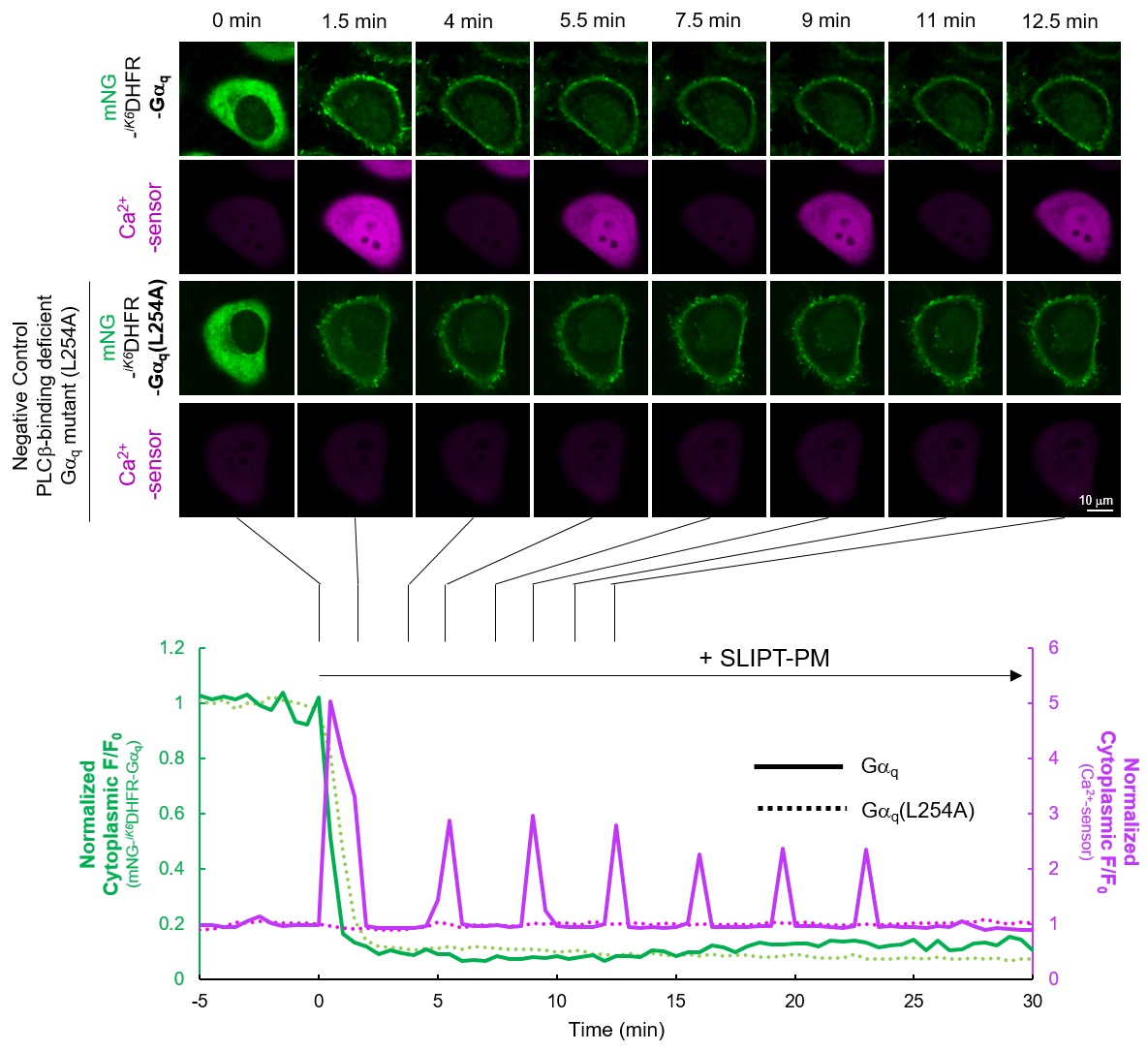
HeLa細胞でmNG-iK6DHFR-Gαqおよび細胞質局在型のカルシウムセンサーを共発現させたところ、mNG-iK6DHFR-Gαqは細胞質に局在し、カルシウムセンサーは定常状態で低蛍光状態である。ここにSLIPT-PMを5 μM添加すると、mNG-iK6DHFR-Gαqは速やかに細胞膜に移行(t1/2~1 min)し、カルシウムセンサーの蛍光が定期的に振動(オシレーション)する様子が観察された。一方で、GαqのPLCβ結合能欠損変異体Gαq(L254A)を有するmNG-iK6DHFR-Gαq(L254A)を発現させた場合、SLIPT-PM添加により細胞膜に移行が観察されるものの、カルシウムセンサーの蛍光変化は観察されなかった。この結果は、SLIPT-PMがmNG-iK6DHFR-Gαqの細胞膜移行を誘導し、Gαqの下流シグナル経路を活性化していることを強く示唆している。
追加しました。
Gαsシグナル経路の活性化
■対象シグナル経路:Gαs → Adenylate cyclase (AC) → cAMP産生
■使用したコンストラクト:
・iK6DHFR融合タンパク質:miRFP670-iK6DHFR-Gαs(addgene ID:172105)、miRFP670-iK6DHFR(addgene ID:178852)
※ 本実験ではGαsはC3S変異体を使用しています。
(C3S:パルミトイル化修飾の欠損変異で自発的な細胞膜結合性を示さない)
・レポータータンパク質:cAMPセンサータンパク質
■SLIPT-PM濃度:SLIPT-PM 10 μM
■使用した細胞:HeLa
■使用した培地:DMEM(無血清培地)
■実験モデル:
GαsはGPCRに結合する三量体Gタンパク質αサブユニットの一つで、GPCRのリガンド結合により活性化し、Adenylate cyclase(AC)の活性化を促します。ACはATPをcAMPに変換し、産生されたcAMPはセカンドメッセンジャーとしてPKAなどの下流シグナルの誘導因子として機能します。
本実験ではSLIPT-PMシステムを利用し、下図のようにmiRFP670-iK6DHFR-GαsをSLIPT-PMにより細胞膜上に輸送することでGPCR刺激なしでもGαsの下流シグナルの活性化を誘導します。アウトプットとして、FRET型のcAMPセンサーを用いて、細胞質のcAMP量を観察しています。
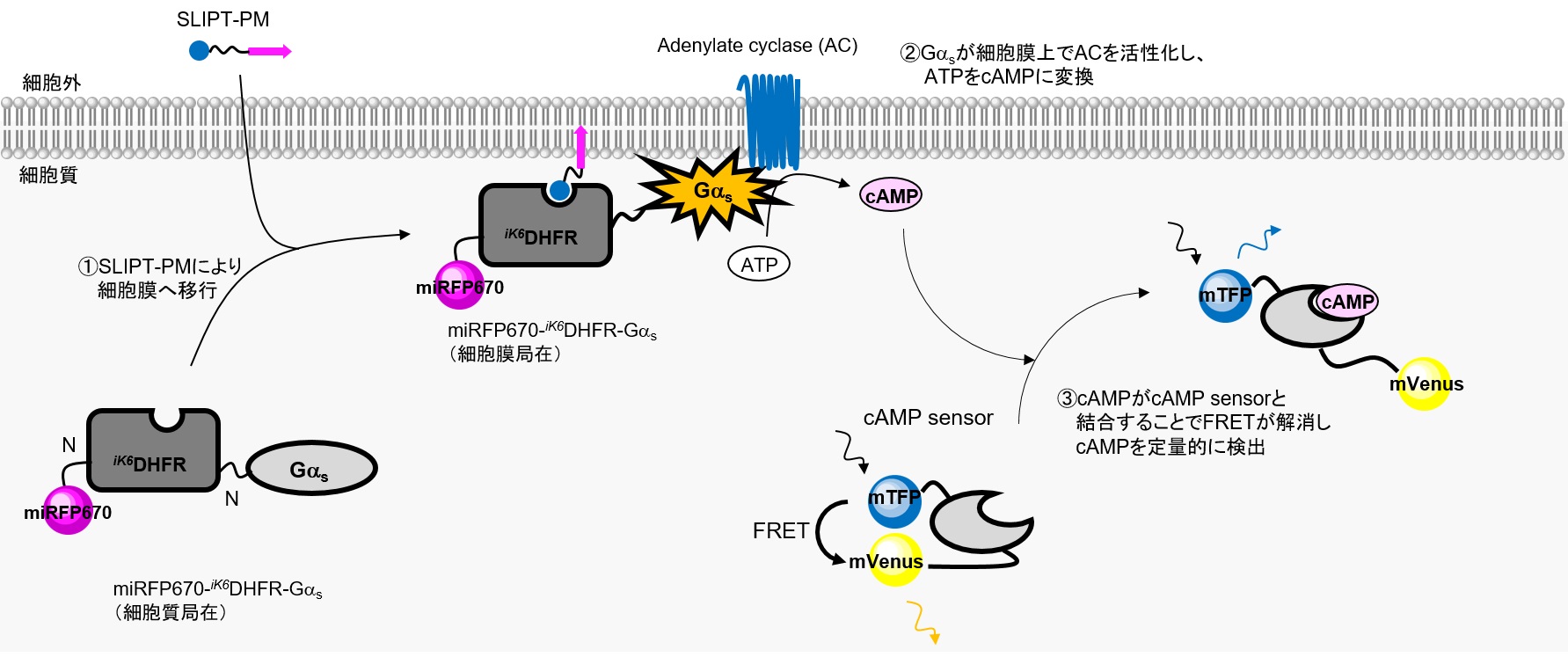
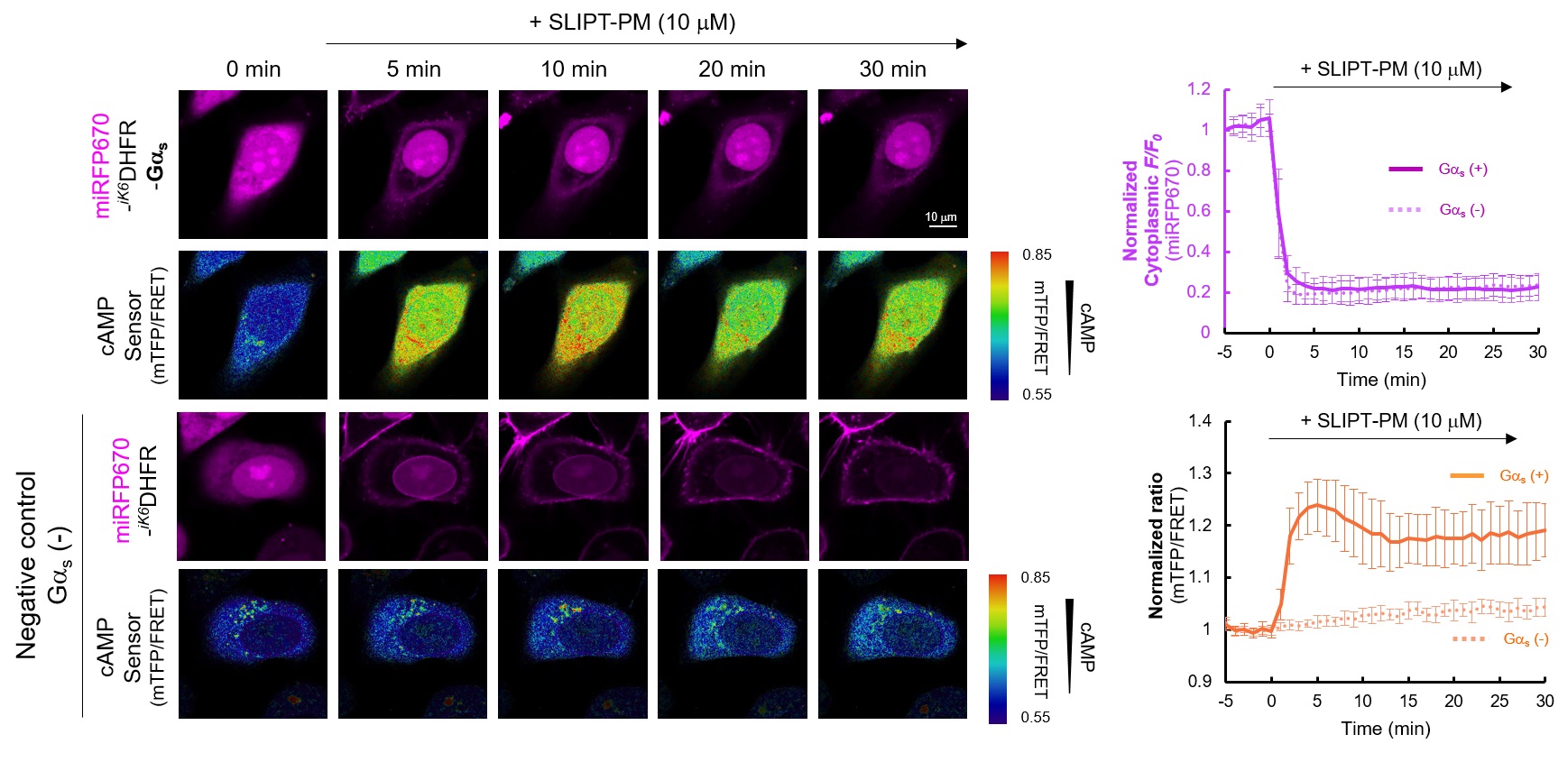
HeLa細胞でmiRFP670-iK6DHFR-GαsおよびFRET(mTFP/mVenus)型cAMPセンサー蛍光タンパク質を共発現させたところ、miRFP670-iK6DHFR-Gαsは細胞質に局在し、cAMPセンサーは低cAMP濃度を示している。ここにSLIPT-PMを10 μM添加すると、miRFP670-iK6DHFR-Gαsは速やかに細胞膜に移行(t1/2~1 min)し、cAMPセンサーのFRETが解消されmTFP/mVenus蛍光強度比が増加する様子が観察されたことから、cAMPの増幅が検出された。一方で、ネガティブコントロールとしてGαsを有さないmiRFP670-iK6DHFRを発現させた場合、SLIPT-PM添加により細胞膜に移行が観察されるものの、cAMPセンサーの変化は観察されなかった。この結果は、SLIPT-PMがmiRFP670-iK6DHFR-Gαsの細胞膜移行を誘導し、Gαsの下流シグナル経路を活性化していることを強く示唆している。
スケールバー 10 μm
追加しました。
RacGEF(Tiam1) - Racシグナル経路の活性化
■対象シグナル経路:Rac-GEF (Tiam1) → Rac → Arp2/3, PAK etc.→ actin重合形成促進 → ラメリポディア形成
■使用したコンストラクト:
・SLIPTタンパク質:mNeonGreen (mNG)-iK6DHFR-Tiam1DH-PH(addgene ID:172102)、mNG-iK6DHFR(addgene ID:178853)
※ 本実験ではTiam1は触媒ドメインであるDH-PHドメインのみを使用しています。
・レポータータンパク質:Actin probe (Actin-binding peptide-tagged mCherry)
■SLIPT-PM濃度:SLIPT-PM 5 μM
■使用した細胞:HeLa
■使用培地:DMEM(無血清培地)
■実験モデル:
Rhoファミリー低分子量Gタンパク質のRacに対するグアニンヌクレオチド交換因子RacGEFであるTiam1は各種レセプターの下流因子として活性化し、Racの活性化を誘導します。RacはArp2/3やPAK等のエフェクター因子の活性化を通じてactin重合を促し、ラメリポディアの形成および細胞の波状運動に寄与することが知られています。
本実験ではSLIPT-PMシステムを利用し、下図のようにmNG-iK6DHFR-Tiam1DH-PHをSLIPT-PMで細胞膜上に輸送することでRacを活性化し、Tiam1-Racの下流シグナルの活性化を誘導します。アウトプットとして、Actin probeを使用し、さらに細胞の構造変化(面積変化)を経時観察しています。
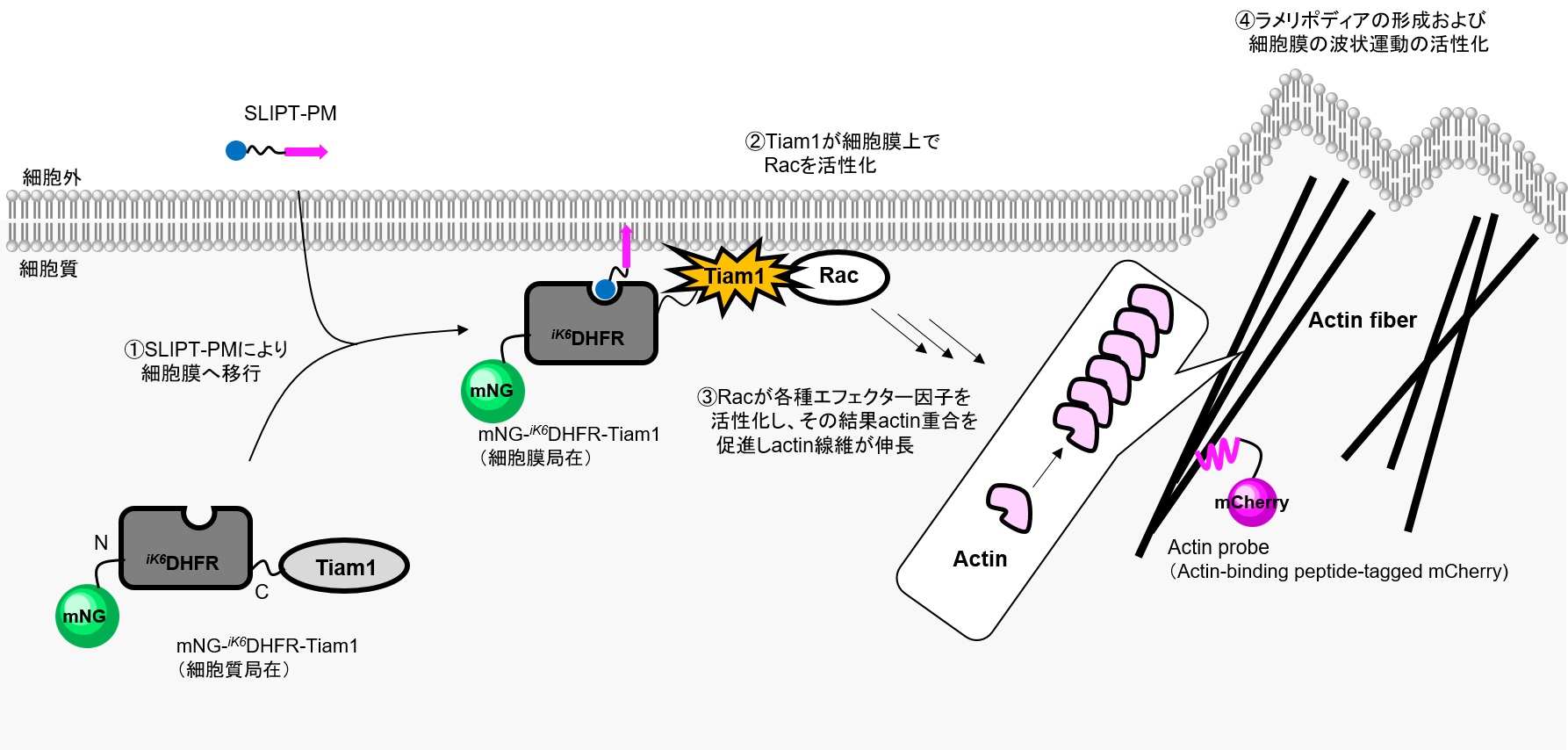
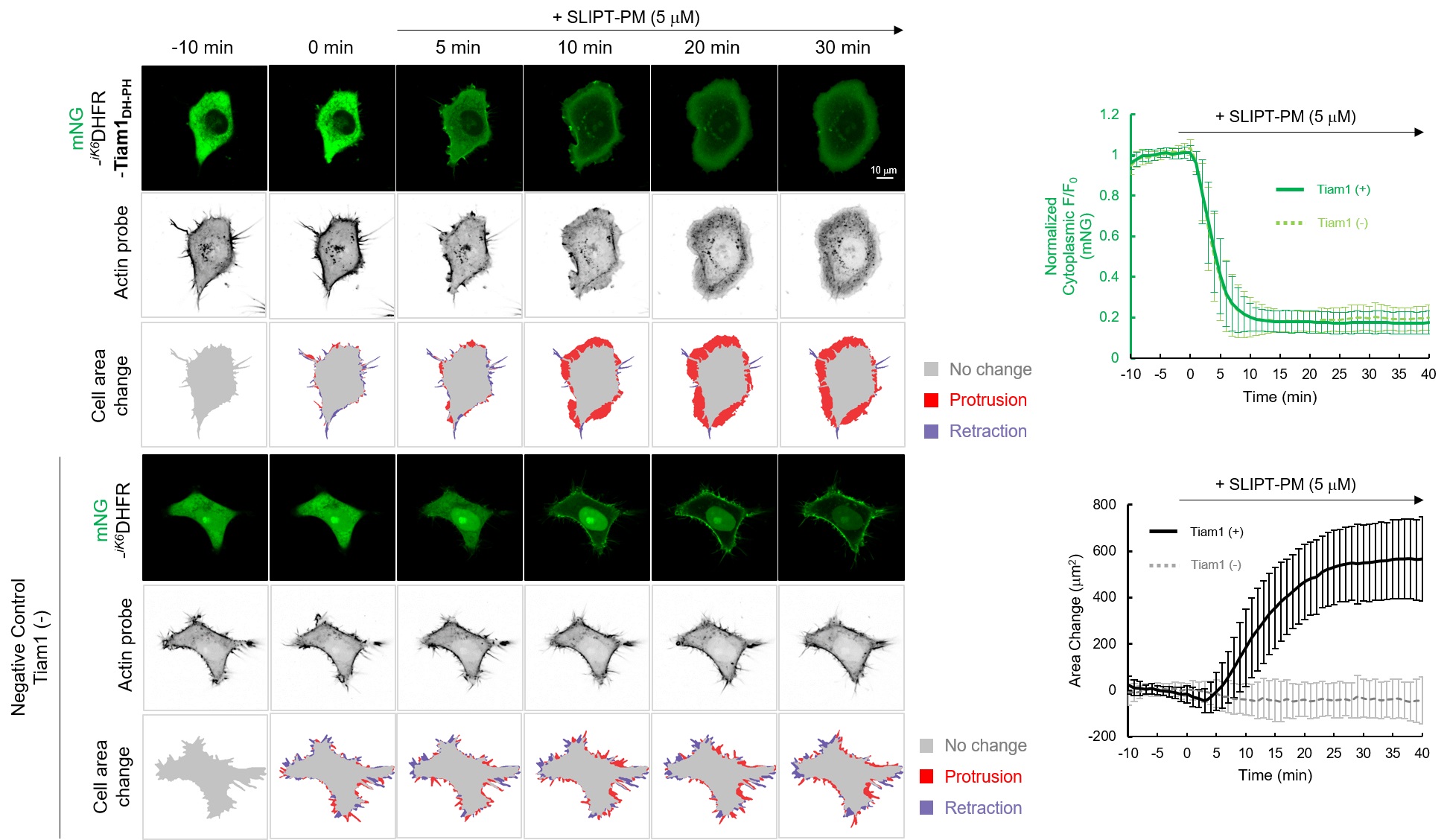
HeLa細胞でmNG-iK6DHFR-Tiam1DH-PHおよびActin probeを共発現させたところ、mNG-iK6DHFR- Tiam1DH-PHは細胞質に局在し、Actin probeはフィロポディア様の構造を示している。ここにSLIPT-PMを5 μM添加すると、mNG-iK6DHFR-Tiam1DH-PHは速やかに細胞膜に移行(t1/2~3 min)し、Actinはフィロポディア構造からラメリポディア構造に大きく変化し、細胞の著しい伸展による面積変化が観察された。一方で、ネガティブコントロールとしてTiam1を有さないmNG-iK6DHFRを発現させた場合、SLIPT-PM添加により細胞膜に移行が観察されるものの、Actin probeの局在変化および細胞構造の変化は観察されなかった。この結果は、SLIPT-PMがmNG-iK6DHFR- Tiam1DH-PHの細胞膜移行を誘導し、RacGEF(Tiam1)を起点とするRacシグナル経路を活性化していることを強く示唆している。
スケールバー 10 μm
追加しました。
PI3K-Aktシグナル経路の活性化
■対象シグナル経路:Phosphoinositide 3-kinase (PI3K) → PI(3,4,5)P3 (PIP3) → Akt
■使用したコンストラクト:
・iK6DHFR融合タンパク質:mNeonGreen (mNG) -iK6DHFR-p85iSH2(addgene ID:172103)、mNG-iK6DHFR(addgene ID:178853)
※ 本実験でp85はPI3Kのサブユニットであるp110結合領域であるiSH2(inter-Src homology 2)ドメイン(p85iSH2と略)のみを使用しています。p85iSH2は内在性のp110と結合しPI3K活性を示します。
・レポータータンパク質:mCherry-AktPH
※ 本実験でAktはPIP3結合ドメインであるpleckstrin homology (PH) ドメイン(AktPHと略)を使用しています。
■SLIPT-PM濃度:SLIPT-PM 10 μM
■使用した細胞:HeLa
■使用培地:DMEM(無血清培地)
■実験モデル:
PI3K(p85/p110複合体)は各種レセプターによって活性化され、PIP2をリン酸化しPIP3に変換します。Serine/threonine kinaseであるAktはPIP3により活性化され、細胞増殖など様々なシグナル伝達に寄与します。
本実験ではSLIPT-PMシステムを利用し、内在性のp110と複合体を形成したmNG-iK6DHFR-p85iSH2をSLIPT-PMにより細胞膜上に移行させることでPIP2からPIP3産生を誘導する。アウトプットとして、PIP3に結合能を示すAktのPHドメイン(AktPH)を融合したmCherry (mCherry-AktPH) を利用し、mCherry-AktPHの細胞膜移行量を観察しています。
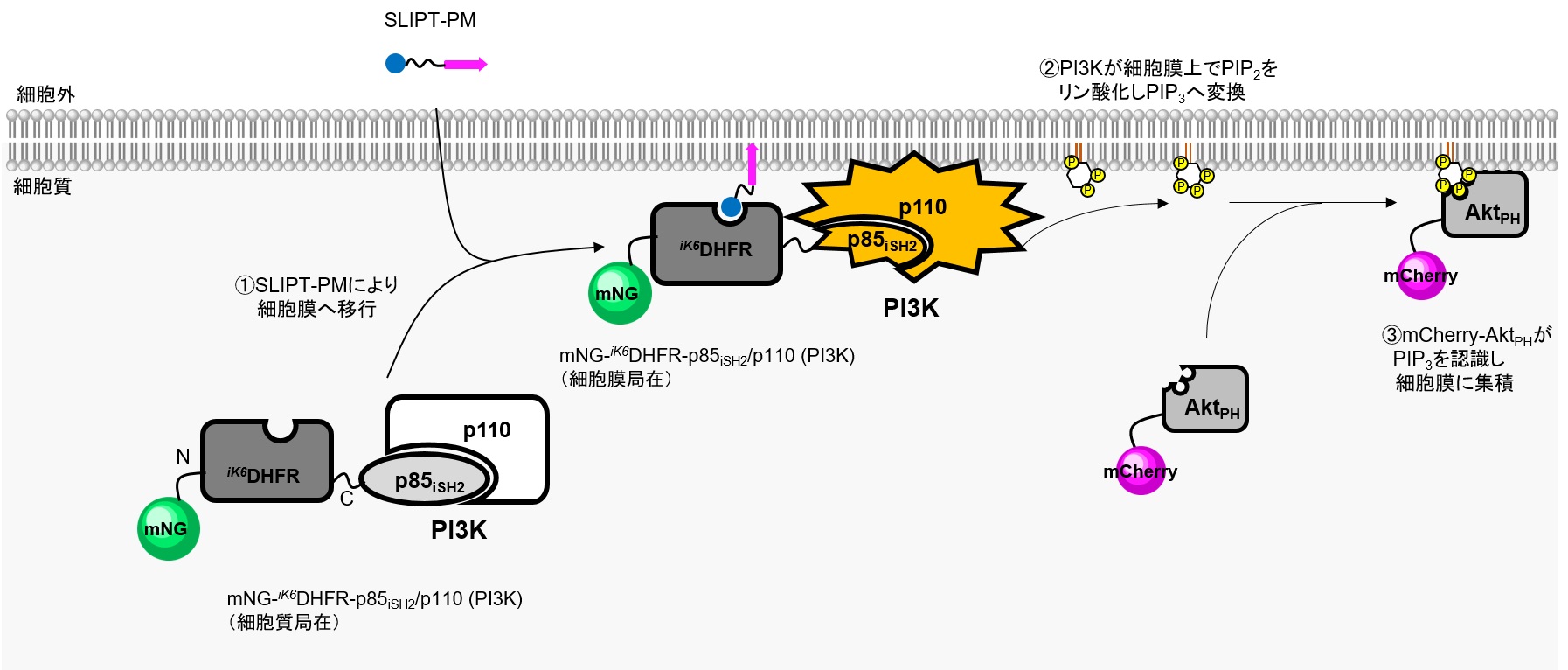

HeLa細胞でmNG-iK6DHFR-p85iSH2およびmCherry-AktPHを共発現させたところ、mNG-iK6DHFR- p85iSH2、mCherry-AktPHともに細胞質に局在している。ここにSLIPT-PMを10 μM添加すると、mNG-iK6DHFR-p85iSH2は速やかに細胞膜に移行(t1/2~2 min)し、ほぼ同時にmCherry-AktPHも細胞膜への移行が見られた。一方で、ネガティブコントロールとしてp85iSH2を有さないmNG-iK6DHFRを発現させた場合、SLIPT-PM添加により細胞膜に移行が観察されるものの、mCherry-AktPHの局在変化は観察されなかった。この結果は、SLIPT-PMがmNG-iK6DHFR-p85iSH2/p110複合体の細胞膜移行を誘導し、PI3Kを起点とするPIP3産生を活性化していることを示唆している。
スケールバー 10 μm
追加しました。
ドメイン置換Grb2様タンパク質によるRasシグナル経路の活性化
■対象シグナル経路:Grb2/SOS1 → Ras → Raf → MEK → ERK
■使用したコンストラクト:
・iK6DHFR融合タンパク質:
ドメイン置換Grb2様タンパク質 Grb2mimic-iRFP713(addgene ID:178854)
※ 本実験では、Grb2のSH2ドメインをiK6DHFRに置き換えたキメラタンパク質をGrb2様タンパク質(Grb2mimicと略)として構築しています。
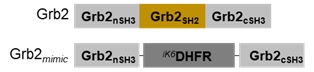
ネガティブコントロール iK6DHFR-iRFP713(addgene ID:178855)
・レポータータンパク質:FRET型Nucleus ERK activity sensor
■SLIPT-PM濃度:SLIPT-PM 5 μM
■使用した細胞:HeLa
■使用培地:DMEM(無血清培地)
■実験モデル:
Grb2はRasGEFであるSOS1と複合体を形成し、EGFRの活性化に応答し、Grb2のSH2ドメイン-EGFR細胞内ドメイン結合を介して、SOS1を細胞膜に局在化します。Grb2により細胞膜上に動員されたSOS1はRasを活性化し、Raf-MEK-ERKシグナル経路の活性化を誘導します。
本実験ではGrb2のSH2ドメインをiK6DHFRに置換したキメラタンパク質Grb2mimicを発現させ、レセプターシグナル非依存的にSLIPT-PMによりGrb2mimic/SOS1複合体を細胞膜上に移行させることでRasを活性化、さらにRaf-MEK-ERK経路のシグナル伝達を誘導します。アウトプットとして、核内移行ERKの活性をFRET型ERKセンサータンパク質で検出します。
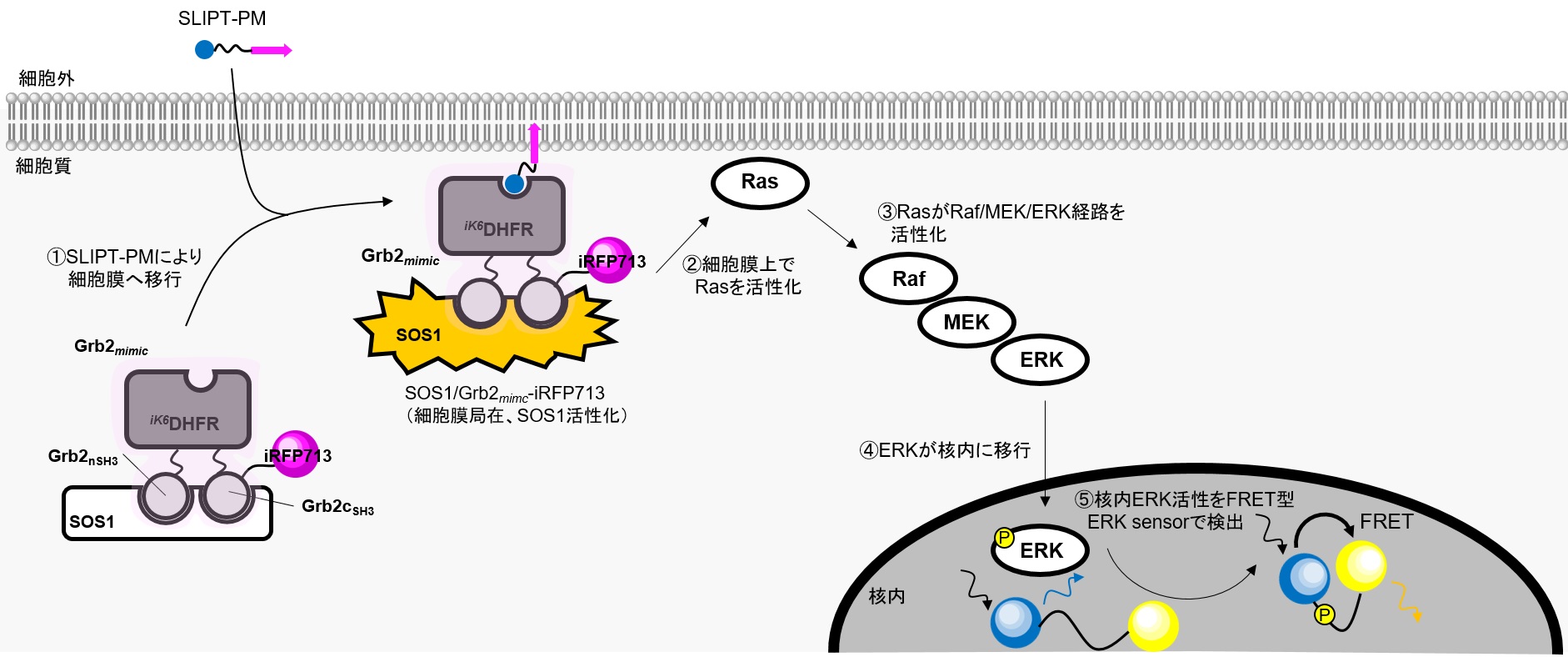
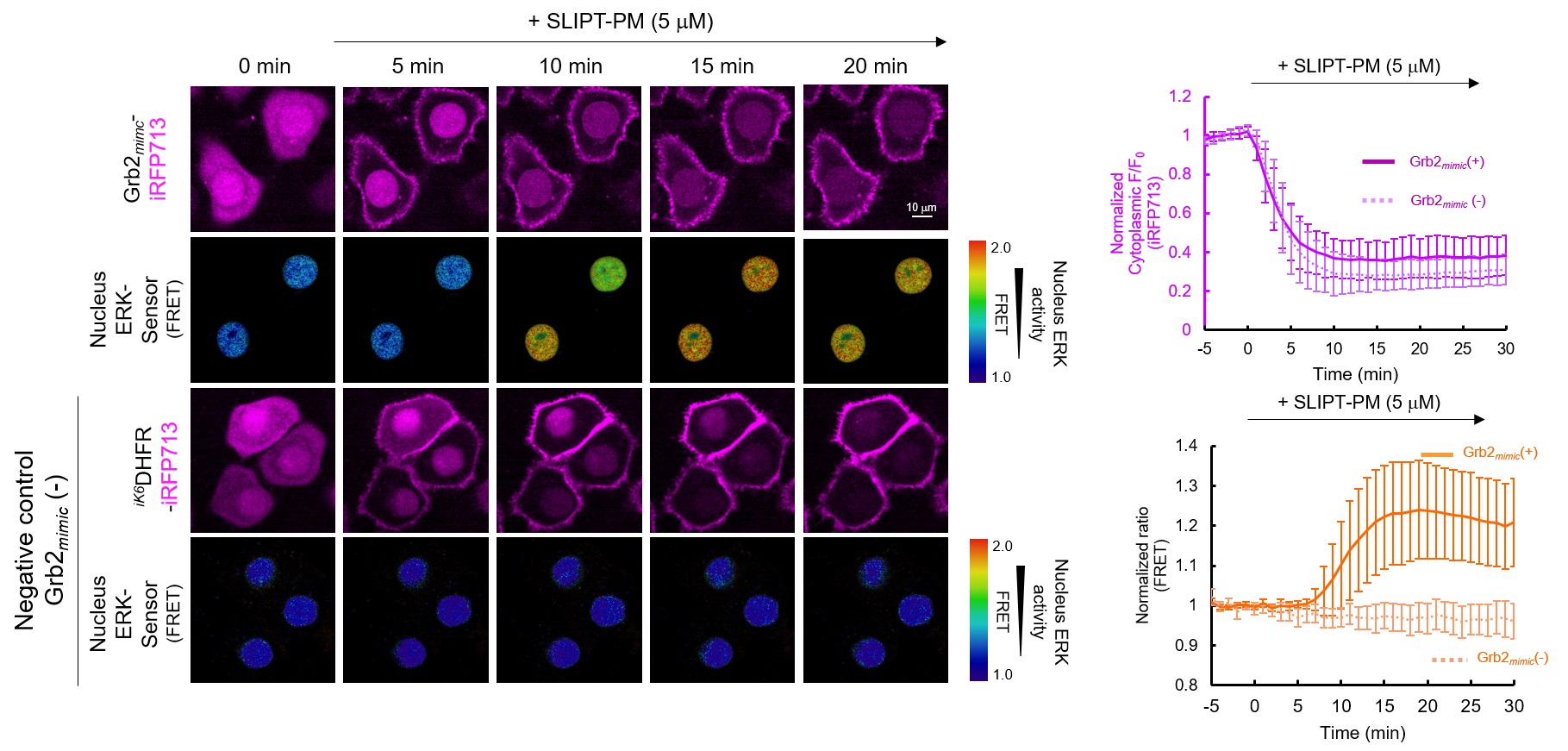
HeLa細胞でGrb2mimic-iRFP713および核内ERKセンサータンパク質を共発現させたところ、Grb2mimic-iRFP713は細胞質に、核内ERKセンサータンパク質は核に局在している。ここにSLIPT-PMを5 μM添加すると、Grb2mimic-iRFP713は速やかに細胞膜に移行(t1/2~5 min)し、それに付随して核内ERKの活性化が観察された。一方で、ネガティブコントロールとしてiK6DHFR-iRFP713を発現させた場合、SLIPT-PM添加により細胞膜に移行が観察されるものの、核内ERKの活性変化は観察されなかった。この結果は、SLIPT-PMがGrb2mimic/SOS1複合体の細胞膜移行を誘導し、SOS1を起点とするRas-MEK-ERKシグナル経路を活性化していることを示唆している。
追加しました。
価格
[在庫・価格 :2026年02月22日 00時00分現在]
| 詳細 | 商品名 |
|
文献数 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
SLIPT-PM |
|
0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
[在庫・価格 :2026年02月22日 00時00分現在]
SLIPT-PM
文献数: 0
- 商品コード:FDV-0045
- メーカー:FNA
- 包装:1kit
- 価格:¥40,000
- 在庫:3個以上
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | ※本製品には専用タグタンパク質の発現ベクターは含まれていません。別途用意が必要です。 「タンパク質の細胞内局在を低分子化合物により制御する基盤技術;SLIPT法」のうち細胞膜輸送に特化した化合物。目的のシグナルタンパク質を専用タグの融合タンパク質としてあらかじめ発現させた細胞にSLIPT-PMを添加することで,目的タンパク質を速やかに細胞膜に輸送することができる。 |
||
|---|---|---|---|
| 法規制等 | |||
| 保存条件 | -20℃ | 法規備考 | |
| 掲載カタログ |
ニュース2023年8月合併号 p.41
|
||
| 製品記事 | タンパク質の細胞膜局在誘導試薬 SLIPT-PM |
||
| 関連記事 | |||
追加しました。
おすすめ製品記事
-
フナコシ株式会社
/ 生細胞を用いた脂肪滴の長時間イメージングに有用です!
LipiDye®Ⅱ -
Columbus Nanoworks, Inc.,(Cymaris Labs)
/ 退色しない蛍光ナノ粒子
蛍光性ナノダイヤモンド -
BioWest
/ 抗体産生、免疫アッセイ、化合物スクリーニング、幹細胞研究に有用なウシ胎児特殊血清
ウシ胎児特殊血清(BioWest社) -
フナコシ株式会社
/ DNA特異的な細胞核ライブイメージング試薬
NucleoSeeing® (Live Nucleus Green)
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。


