HOME
>
試薬
>
細胞情報伝達
>
リン酸化
>
タンパク質の細胞膜局在誘導試薬 SLIPT-PM
HOME
>
試薬
>
細胞情報伝達
>
Gタンパク質/環状ヌクレオチド
>
Gタンパク質(GPCR)関連商品
>
タンパク質の細胞膜局在誘導試薬 SLIPT-PM
細胞膜を起点とした経路特異的なシグナル伝達の活性化に! タンパク質の細胞膜局在誘導試薬 SLIPT-PM
掲載日情報:2022/07/14 現在Webページ番号:70604

フナコシ /
フナコシ株式会社
[メーカー略称:FNA]
SLIPT法はタンパク質の細胞内局在を低分子化合物により制御する基盤技術で、SLIPT-PMはSLIPT法において細胞膜への局在移行を誘導する化合物です。
目的のシグナルタンパク質を専用タグiK6DHFRの融合タンパク質としてあらかじめ発現させた細胞にSLIPT-PMを添加することで、目的タンパク質を速やかに細胞膜に輸送することができます。細胞膜上で機能活性化を示すシグナルタンパク質であれば、リガンドによる上流レセプターの刺激を必要とすることなく、下流のシグナル経路を活性化することができ、狙ったシグナル経路に着目した各種解析を行うことができます。
※ 本製品は名古屋工業大学の研究成果をもとにフナコシ(株)が製品化し、販売しています。
※ ☞ SLIPT-PMのアプリケーション例はこちらの記事をご覧下さい。
※ 本製品は研究用です。研究用以外には使用できません。
追加しました。
SLIPT法およびSLIPT-PMについて
SLIPT法とは
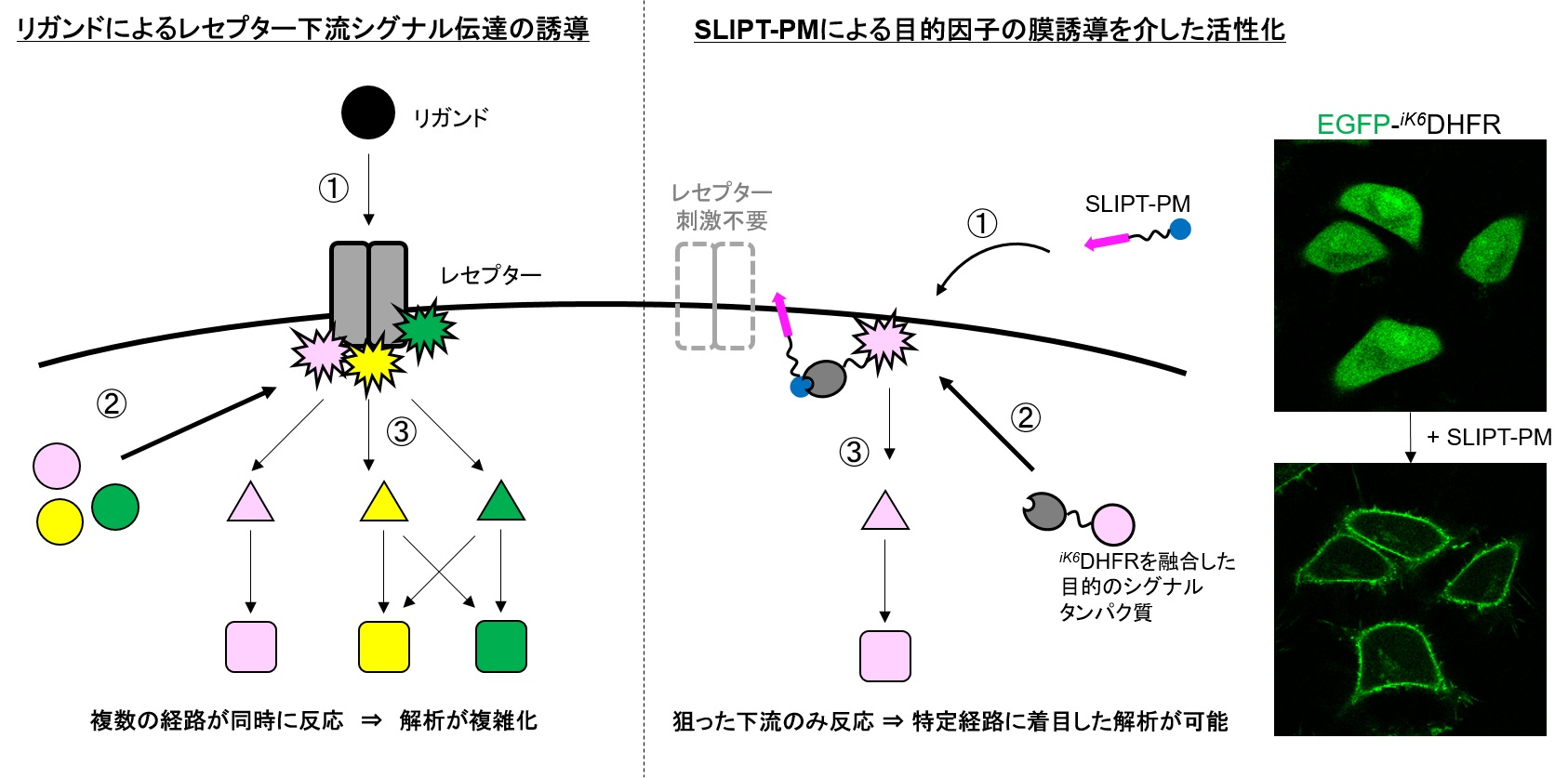
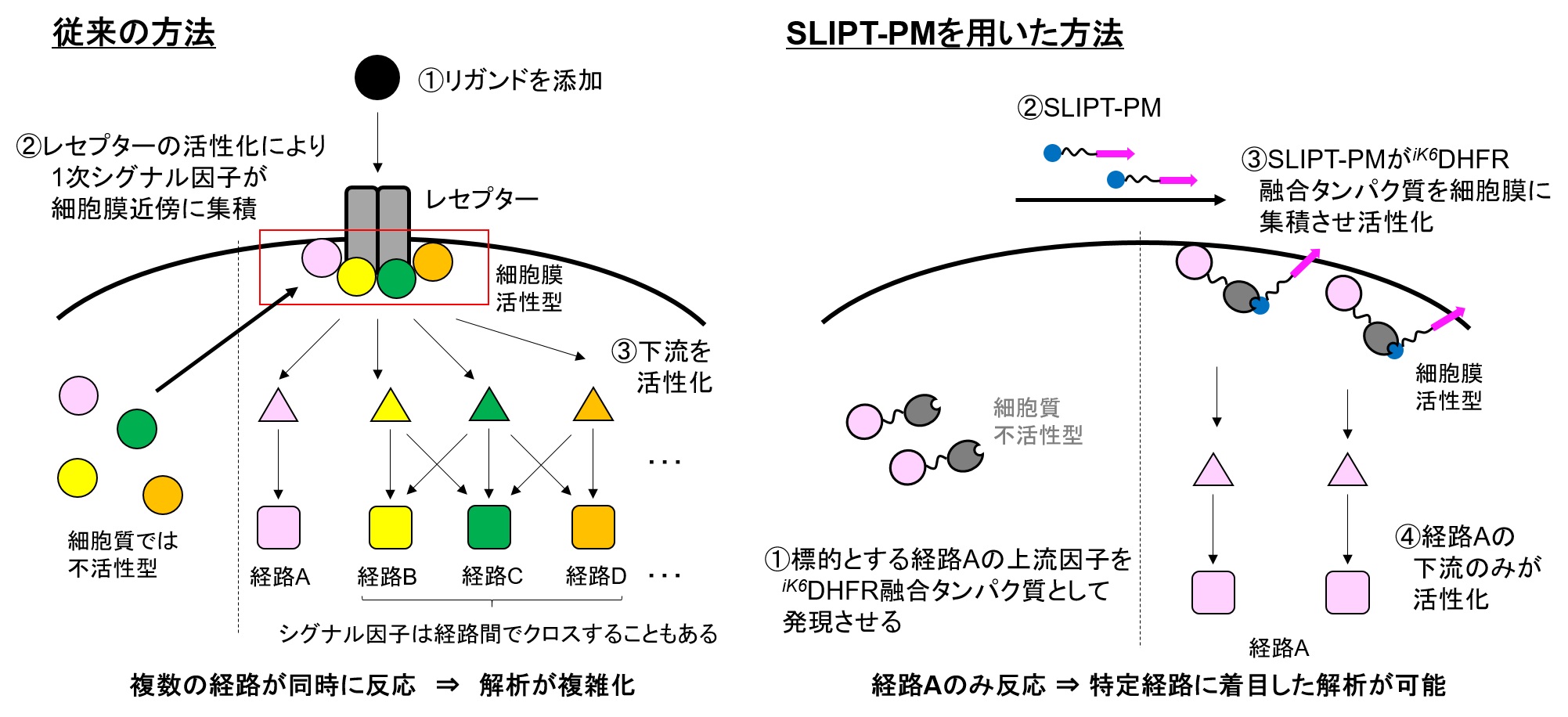
従来、シグナル伝達の解析はシグナル経路の最上流であるレセプターのリガンドによる活性化を起点とし、その応答を観察することが一般的でした。しかし、リガンドを用いてレセプターを活性化するとレセプターの下流の様々なシグナル経路が同時に活性化され、複数のシグナル経路の総和の応答が観察されます。個々のシグナル経路は相互にクロストークすることもあり、さらに解析を複雑化しています(左図)。この課題を解決するため様々な解析ツールの開発が進められていますが、特定のシグナル経路のみを活性化できるような汎用的技術は不十分でした。
図をクリックすると拡大します( )
)
SLIPT法(Self-localizing ligand-induced protein translocation)は、2013年に現・名古屋工業大学 築地真也 教授らにより開発された「化合物によりタンパク質の細胞内局在をコントロールする基盤技術」で、オルガネラ移行性の化合物を用いて狙ったタンパク質を特定のオルガネラに局在化させることに成功しています。SLIPT-PMは、SLIPT法に用いる化合物のうち細胞膜への局在誘導に特化した化合物で、任意の標的タンパク質をiK6DHFRと呼ばれるSLIPT-PM専用のタグタンパク質と繋いだ融合タンパク質(以下iK6DHFR融合タンパク質と略)として細胞に発現させることで、SLIPT-PM添加後数分単位の時間軸で細胞膜に移行させることができます。iK6DHFR融合タンパク質として発現させる標的タンパク質が、細胞膜上で活性化し下流シグナル因子を誘導できる性質を示すものであれば、iK6DHFR融合タンパク質の発現細胞にSLIPT-PMを添加することで、標的タンパク質よりも上流シグナルを必要とせず、下流シグナルの活性化を誘導することが可能です。
実際に、下記の代表的なシグナル経路についてレセプターの活性化を用いずに、中間因子から特異的に活性化することに成功しています(右図)。
- cRaf-MEK-ERK経路
- RasGEF-Ras-Raf-MEK-ERK経路
- Gαq-PLCβ-PIP2-IP3-Ca2+経路
- Gαs-adenylate cyclase-cAMP経路
- PI3K-PIP3-Akt経路
- RacGEF-Rac-actin経路
- PKCσ-Raf-MEK-ERK経路
SLIPT-PMを使うには何が必要?
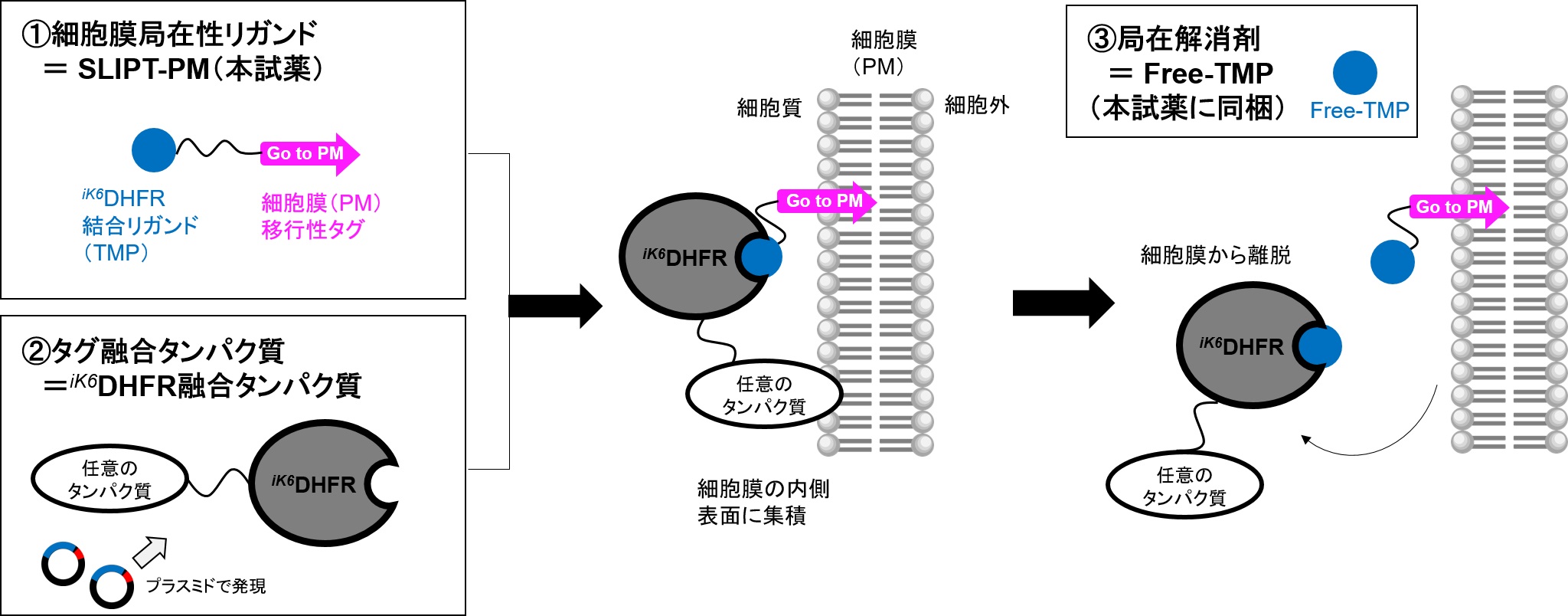
SLIPT法は3種類のコンポーネント、①オルガネラ局在を決める局在性リガンドと②リガンドに結合するタグタンパク質、および③局在解消剤から構成されます。①局在性リガンドで②タグタンパク質を局在移行させたのち、任意のタイミングで③局在解消剤を添加することで、タグタンパク質に融合した任意のタンパク質の局在を可逆的に制御することができます。
SLIPT-PM(本試薬)は細胞膜選択的な①局在性リガンドで、本試薬とは別途②タグタンパク質の発現用にiK6DHFR融合タンパク質発現ベクターをご準備いただく必要があります。iK6DHFR融合タンパク質発現ベクターはプラスミドバンクであるaddgeneより入手いただくことが可能です。詳しくは、後述の☞ SLIPT-PM実験の始め方をご参照下さい。
図をクリックすると拡大します( )
)
※ 詳細な学術背景や原理などは☞ SLIPT-PMユーザーガイドブックをご参照下さい。
追加しました。
デモンストレーション
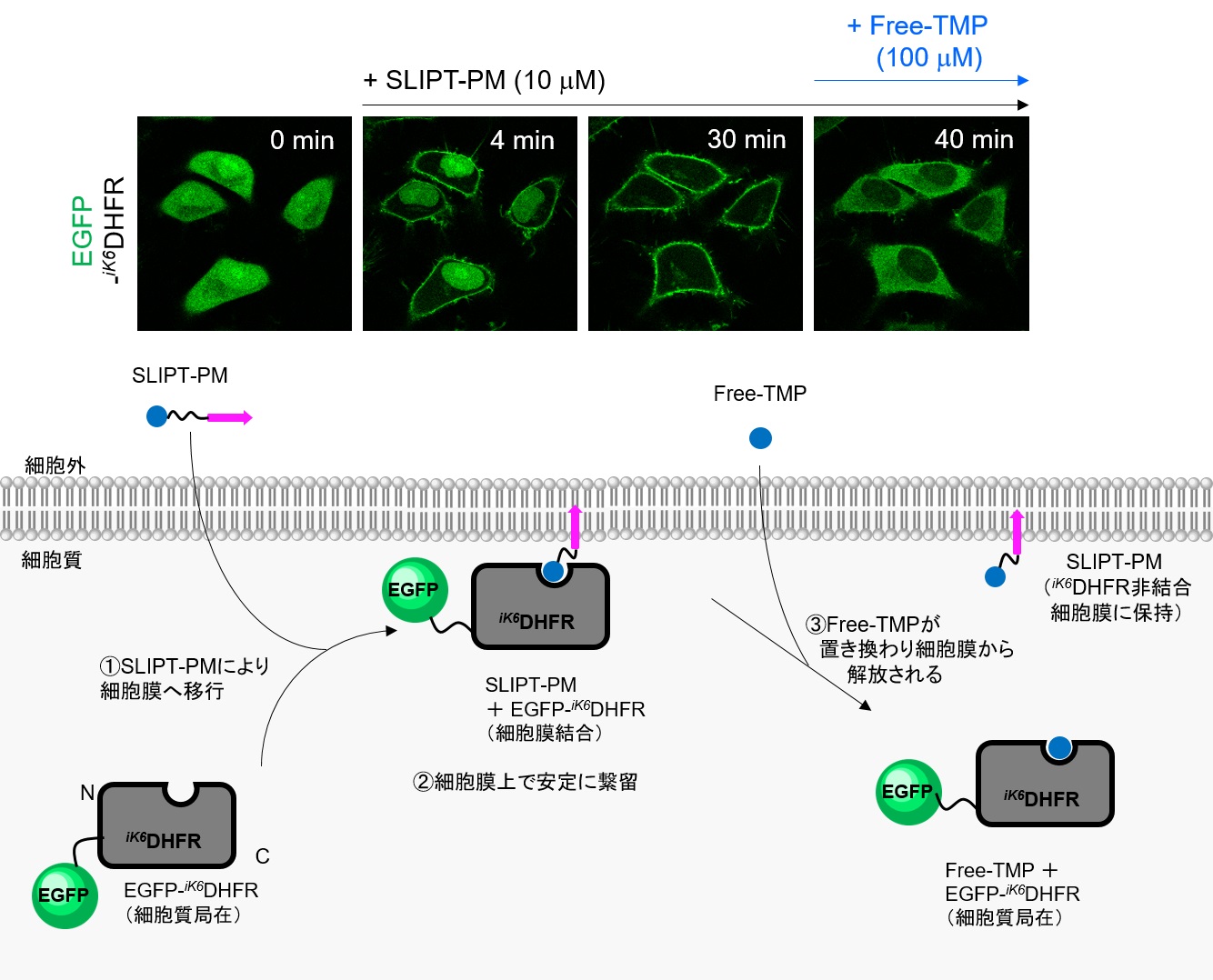
SLIPT-PMによるiK6DHFR融合EGFPの細胞膜局在化とFree-TMPによる膜局在の解消
図をクリックすると拡大します( )
)
SLIPT-PMによるiK6DHFR融合EGFPの細胞膜局在化とFree-TMPによる膜局在の解消
追加しました。
アプリケーション例
下記のシグナル経路について、実験モデルと実績結果をご参照いただけます。
| 経路 | 活性化因子 | 下流因子 | 紹介ページ |
|---|---|---|---|
| Ras経路 | Raf | MEK-ERK | ☞ こちらをクリック |
| Grb2/SOS1 | Ras-Raf-MEK-ERK | ☞ こちらをクリック | |
| Gαq経路 | Gαq | PLCβ-PIP2-IP3 | ☞ こちらをクリック |
| Gαs経路 | Gαs | Adenylate cyclase-cAMP | ☞ こちらをクリック |
| RacGEF-Rac経路 | RacGEF(Tiam1) | Rac-actin | ☞ こちらをクリック |
| PI3K-Akt経路 | PI3K | PIP3-Akt | ☞ こちらをクリック |
追加しました。
SLIPT法およびSLIPT-PMの詳細
SLIPT法およびSLIPT-PMの学術背景や原理、実験構築の注意点などは☞ SLIPT-PMユーザーガイドブックに詳述しております。ご購入を検討されている方は、下記よりダウンロードのうえご参照下さい。
☞ SLIPT-PMユーザーガイドブックのダウンロードはこちら
追加しました。
キット内容
- SLIPT-PM(0.2 mg/vial)
- SLIPT supplement (Free-TMP)(5 mg/vial)*
* 局在解消剤として使用
※ 注意:iK6DHFR発現プラスミドは本製品に同梱されていません。 ☞ SLIPT-PM実験の始め方をご参照いただき、適切なiK6DHFR発現プラスミドを別途ご用意いただく必要があります。
追加しました。
SLIPT-PM実験の始め方
SLIPT-PM (#FDV-0045)とは別にiK6DHFR発現プラスミドをご準備いただく必要があります。試薬SLIPT-PMのご購入だけではSLIPT法は実施できませんので、下記のフローをご購入前に必ずご参照下さい。
iK6DHFR発現プラスミドの選択方法・入手方法
マルチクローニングサイトを有するiK6DHFR発現プラスミド(EGFP融合タンパク質)およびポジティブコントロール用発現プラスミドはaddgeneで入手いただく、またはeDHFR (WT) をもとにご作製いただく必要があります。addgeneのプラスミド登録情報は下記をご参照下さい。
本ウェブ記事で紹介する各種アプリケーション実験に使用されている発現プラスミドもaddgeneから入手できます。eDHFR (WT) をもとにご自身で作製される場合は、☞ 参考文献3をご参照下さい。
| 用途 | プラスミド名 | addgene ID |
|---|---|---|
| 任意のタンパク質XをiK6DHFRのC末端に入れたい (EGFP-iK6DHFR-X) |
pCMV-EGFP-eDHFR(69K6)-MCS | 172100 |
| 任意のタンパク質XをiK6DHFRのN末端に入れたい (X-iK6DHFR-EGFP) |
pCMV-MCS-eDHFR(69K6)-EGFP | 172101 |
※ iK6DHFR=eDHFR(69K6)
各種ポジティブコントロール用発現プラスミド
| 活性化する経路 | 本マニュアルにおけるコンストラクト名 | addgeneプラスミド名 | addgene ID |
|---|---|---|---|
| cRaf-MEK-ERK経路 | EGFP-iK6DHFR-cRaf | pPBpuro-EGFP-eDHFR(69K6)-cRaf | 178849 |
| cRaf-mNeonGreen(mNG)-iK6DHFR | pPBpuro-cRaf-mNG-eDHFR(69K6) | 172107 | |
| Gαq経路 | mNeonGreen(mNG)-iK6DHFR-Gαq | pCAGGS-mNG-eDHFR(69K6)-G-alpha-q | 172106 |
| mNeonGreen(mNG)-iK6DHFR-Gαq (L254A) | pCAGGS-mNG-eDHFR(69K6)-G-alpha-q(L254A) | 178851 | |
| Gαs経路 | miRFP670-iK6DHFR-Gαs | pPBpuro-miRFP670-eDHFR(69K6)-G-alpha-s | 172105 |
| miRFP670-iK6DHFR | pCSIIpuro-miRFP670-eDHFR(69K6) | 178852 | |
| PI3K-Akt経路 | mNeonGreen(mNG)-iK6DHFR-p85iSH2 | pPBpuro-mNG-eDHFR(69K6)-p85iSH2 | 172103 |
| mNeonGreen(mNG)-iK6DHFR | pCSIIpuro-mNG-eDHFR(69K6) | 178853 | |
| RacGEF-Rac経路 | mNeonGreen(mNG)-iK6DHFR-Tiam1DH-PH | pPBpuro-mNG-eDHFR(69K6)-Tiam1 | 172102 |
| mNeonGreen(mNG)-iK6DHFR | pCSIIpuro-mNG-eDHFR(69K6) | 178853 | |
| Grb2/SOS1-Ras-Raf-MEK-ERK経路 | Grb2mimic-iRFP713 | pCAGGS-chGrb2/eDHFR(69K6)-iRFP713 | 178854 |
| iK6DHFR-iRFP713 | pCAGGS-eDHFR(69K6)-iRFP713 | 178855 |
※ 各実験例は上記☞ アプリケーション例をご参照下さい。
追加しました。
使用文献
- Hino, N., et al., "A feedback loop between lamellipodial extension and HGF-ERK signaling specifies leader cells during collective cell migration.", Dev. Cell, 57(19), 2290~2304 (2022). [PMID:36174555]
追加しました。
参考文献
- SLIPTの原著論文:
Ishida, A.,et al., "Synthetic self-localizing ligands that control the spatial location of proteins in living cells.", J. Am. Chem. Soc., 135(34), 12684~12689 (2013). [PMID:23941503] - SLIPT-PM (mDcTMP) の原著論文:
Nakamura, A., et al., "Designer palmitoylation motif-based self-localizing ligand for sustained control of protein localization in living cells and Caenorhabditis elegans.", ACS Chem. Biol., 15(4), 837~843 (2020). [PMID:32182034] - SLIPT-PM (mDcTMP)とiK6DHFRペアの原著論文:
Suzuki, S., et al., "A chemogenetic platform for controlling plasma membrane signaling and synthetic signal oscillation.", Cell Chem. Biol., 29(9) (2022). [PMID:35835118] - SLIPT-PMの日本語総説:
築地真也、細胞内シグナル分子を特異的に活性化する新ツール"SLIPT"、『生体の科学』、74、595~601 (2023).
[医書.jp URL:https://webview.isho.jp/journal/detail/abs/10.11477/mf.2425201798]
追加しました。
価格
[在庫・価格 :2026年02月23日 10時35分現在]
| 詳細 | 商品名 |
|
文献数 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
SLIPT-PM |
|
0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
[在庫・価格 :2026年02月23日 10時35分現在]
SLIPT-PM
文献数: 0
- 商品コード:FDV-0045
- メーカー:FNA
- 包装:1kit
- 価格:¥40,000
- 在庫:3個以上
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | ※本製品には専用タグタンパク質の発現ベクターは含まれていません。別途用意が必要です。 「タンパク質の細胞内局在を低分子化合物により制御する基盤技術;SLIPT法」のうち細胞膜輸送に特化した化合物。目的のシグナルタンパク質を専用タグの融合タンパク質としてあらかじめ発現させた細胞にSLIPT-PMを添加することで,目的タンパク質を速やかに細胞膜に輸送することができる。 |
||
|---|---|---|---|
| 法規制等 | |||
| 保存条件 | -20℃ | 法規備考 | |
| 掲載カタログ |
ニュース2023年8月合併号 p.41
|
||
| 製品記事 | SLIPT-PMのアプリケーション例 |
||
| 関連記事 | |||
追加しました。
おすすめ製品記事
-
Columbus Nanoworks, Inc.,(Cymaris Labs)
/ 退色しない蛍光ナノ粒子
蛍光性ナノダイヤモンド -
BroadPharm
/ バイオラベリング用蛍光色素標識試薬
Fluorescein Labeling Reagent -
BioWest
/ 抗体産生、免疫アッセイ、化合物スクリーニング、幹細胞研究に有用なウシ胎児特殊血清
ウシ胎児特殊血清(BioWest社) -
フナコシ株式会社
/ DNA特異的な細胞核ライブイメージング試薬
NucleoSeeing® (Live Nucleus Green)
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。