HOME > 試薬 > 免疫化学 > 免疫染色(免疫組織染色) > 組織切片 > Visikol HISTO使用例(乳房組織)
各種組織切片用の透明化試薬 Visikol HISTO使用例(乳房組織)
掲載日情報:2018/11/26 現在Webページ番号:68569
Visikol社の組織透明化試薬Visikol HISTOを用いた乳房組織の顕微鏡観察例をご紹介いたします。
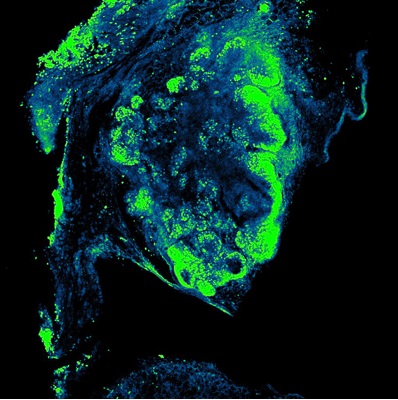
Visikol HISTO-1/2を用いてPyMTトランスフェクトマウス乳房腫瘍組織を透明化処理し、Ki67 Cell Proliferation Labelingを用いて標識した。撮影:直立共焦点顕微鏡、10×空気対物レンズ
追加しました。
関連記事
項目をクリックすると詳細をご覧いただけます。
| 製品ページ | Visikol HISTO | Visikol HISTO-M | ||
|---|---|---|---|---|
| 使用例紹介ページ | マウス脳 | ラット脳 | 乳房組織 | オルガノイド |
追加しました。
試薬、器具・機器
試薬
| 試薬名 | 容量(1試料当たり) |
|---|---|
| Visikol HISTO-1 | 6 ml |
| Visikol HISTO-2 | 6 ml |
| Penetration buffer (PBS / 0.2% Triton X-100 / 0.3M glycine / 20% DMSO) |
6 ml |
| 10×Washing buffer (10×PBS with 2% Tween 20 and 100μg/ml heparin) |
6 ml |
| Blocking buffer (PBS / 0.2% Triton X-100 / 6% donkey serum / 10% DMSO) |
3 ml |
| Antibody buffer (PBS / 0.2% Tween 20 / Heparin / 3% donkey serum / 5% DMSO) | 6 ml |
| 一次抗体、二次抗体 | |
| 核染色液 (e.g. DAPI, Hoeschst, SYTOX, or TO-PRO stains) |
|
| メタノール(無水、試薬グレード) | 80 ml |
| PBS | 60 ml |
| PBS with 1% Triton X-100 | 12 ml |
| DMSO | 2.4 ml |
器具・機器
- ガラス、ポリプロピレンまたはポリエチレン製容器
- 直立共焦点顕微鏡、×10空気対物レンズ
※ 注意事項
- 各抗体の希釈率、インキュベーション時間などについては、それぞれのプロトコルに従って最適化が必要となります。
- ポリスチレン製容器はVisikol HISTO-2には適合しないため、ご使用は避けて下さい。
- 以下の操作について、特に指定のない場合においては、すべての操作は室温、密閉容器中、緩和な撹拌下で実施して下さい。
追加しました。
組織の処理方法
- 適切な固定剤で組織を24時間固定する。固定剤を除去し、0.05%アジ化ナトリウム含有PBSに移し、組織を保存する。
- 残留する固定剤を除去するために15 ml以上のPBS中で1時間以上組織を洗浄する。
- 凍結保存した組織の場合では、さらにPBS 15 mlで1時間の洗浄を3~5回行い、封入剤(Mounting Media)を完全に除去する。
追加しました。
組織への浸透方法
- 室温下で、組織をPBS 15 ml中で45分間、次に50%メタノール(in PBS) 15 ml中で45分間、80%メタノール(in dH2O)15 mlで45分間、最後に100%メタノール 15 ml中で45分間洗浄する。組織は、4℃(推奨)、メタノール中で保存することができる。*1
- 室温下で、組織を20%DMSO/メタノール 6 ml中で45分間×2回洗浄する。
- 室温下で、組織を80%メタノール(in H2O) 6 ml中で45分間洗浄する。
- 室温下で、組織を50%メタノール(in PBS)6 ml中で45分間洗浄する。
- 室温下で、組織をPBS 6 ml中で45分間×2回洗浄する。
- 室温下で、組織をPBS/1% Triton X-100 6 ml中で45分間×2回洗浄する。
- 室温下で、組織をPenetration buffer 6 ml中で緩やかな撹拌しながら2時間インキュベートする。
- 37℃で、組織をBlocking buffer 3 ml中で穏やかに撹拌しながら13.5時間ブロッキングする。
- Antibody buffer 3 mlで調製した一次抗体希釈液に組織を加え、37℃で穏やかに撹拌しながら13.5時間インキュベートする。
- 使用前に10×Washing bufferを希釈し、1×Washing bufferを調製する。
- 組織を37℃で穏やかに撹拌しながら、1×Washing buffer 6 ml中で45分×5回洗浄する。
- 最適化実験の結果に基づき、核染色試薬を1:100~1:5,000の希釈率で二次抗体のAntibody bufferに添加する。
- Antibody buffer 3 mlで調製した二次抗体希釈液(一次抗体の希釈率に基づき1:50~1:500)に組織を加え、37℃で穏やかに撹拌しながら13.5時間インキュベートする。
- 組織を37℃で穏やかに撹拌しながら、1×Washing buffer 6 ml中で45分間×5回洗浄する。必要に応じて、組織はこの溶液中で保存することができる。
*1 着色が著しい組織の場合、氷冷した5% H2O2(in 20% DMSO /メタノール、30% H2O2:DMSO:メタノール=1:1:4)に浸漬し、4℃で一晩放置することにより色素の影響を顕著にを改善することができます。
追加しました。
組織の透明化方法
- 室温下で、組織を50%メタノール 15 ml(in PBS)中で緩和に撹拌しながら45分間、次に70%メタノール(in PBS) 15 ml中で45分間処理する。
- 室温下で、組織を100%メタノール 15 ml中で緩和に撹拌しながら45分間処理する。
- 組織をメタノールから取り出し、過剰のメタノールをキムワイプまたはペーパータオルで吸収する。
- Visikol HISTO-1を6 ml以上加え、組織を完全に覆い、室温下で6時間インキュベートする。
- Visikol HISTO-2を6 ml以上の中に組織を移しかえて、室温下で6時間透明化処理を行う。
※ 最適な結果を得るためには、イメージングをVisikol HISTOにより直接行う必要があるため、Visikol HISTOで組織による透明化の処理後は、他の透明化剤を用いないで下さい。Visikol HISTO溶液には退色防止剤が含まれているため、透明化後の組織をさらに退色防止剤中に封入する必要はありません。他の溶液(特に水性媒体)は、組織を曇らせたり、透明化を逆行させ、3D画像化を阻害します。
追加しました。
3D画像化後の非透明化処理
Visikol HISTOによる透明化を行った組織は、組織学的または生化学的アッセイのために、室温下で100%エタノール 15 ml×3回洗浄することにより非透明化を行うことができます。非透明化処理後は、SDS-PAGE、ウエスタンブロッティング、組織包埋・切片作製、H&E、Nissl、IHCなどの組織学的染色を行うことができます。
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。


