HOME
>
試薬
>
天然物/有機化合物/糖質
>
糖質
>
糖
>
糖質研究用商品
>
名前が何だっていうの? 糖鎖、糖、レクチン …!
HOME
>
試薬
>
天然物/有機化合物/糖質
>
レクチン
>
名前が何だっていうの? 糖鎖、糖、レクチン …!
名前が何だっていうの? 糖鎖、糖、レクチン …!
掲載日情報:2023/08/28 現在Webページ番号:71277
追加しました。
Vector Laboratories社のサイエンスブログ(SpeakEasy Science Blog)からレクチンに関するブログをご紹介します。
※ Vector Laboratories社のレクチンに関する他のブログについては、サイエンスブログ「レクチン」からご覧下さい。
※ Vector Laboratories社のレクチン製品は標識・非標識レクチンをご覧下さい。
by Hikmet Emre Kaya, Ph.D.
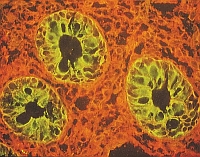
Lycopersicon esculentumレクチンを用いた結腸の染色像
何十年にもわたる研究と技術の進歩にもかかわらず、人類は依然として、致命的ではないにしても治療の困難な病気と闘っています。どのようにして正常細胞から腫瘍細胞に移行するのかなど、未解決の疑問が数多くあります。しかし、細胞表面の修飾がウイルス感染、炎症、自己免疫疾患、がんの発症に重要な役割を果たしていることはわかっています。特に、糖鎖は細胞が互いにどのようにコミュニケーションをとり、また細胞がどのような環境にあるかを決定します。糖鎖とその化合物は驚くほど多様であるため、糖鎖生物学を深く掘り下げる前に、基本を十分に理解する必要があります。
単糖類: 糖の構成要素

糖鎖の構成要素である単糖類に触れずに糖鎖生物学を語ることはできません。
単糖類という言葉は、ギリシャ語のモノ(1つ)とサッカライド(甘味)に由来しており、実際には単糖の洒落た呼び方にすぎません。これらの糖は一般式 Cx(H2O)n となります。
ほとんどの方は、グルコース、フルクトース、ガラクトースという3つの一般的な単糖についてよくご存じです。人間はさまざまな食物源からこれらを摂取し、脳、筋肉、その他の器官の主なエネルギー源として使用します。
構造の違いがあるにもかかわらず、上記の3つの仲間を含むすべての単糖は物理的および化学的特性が似ています。直鎖状では、単糖類には1つのカルボニル基 (C=O) があり、他の炭素には1つのヒドロキシ基 (-OH) が結合しています。カルボニル基は鎖の末端に現れて糖鎖をアルデヒド H(C=O)- にするか、中間のどこかに現れてケトン -(C=O)- にしたりします。
ほとんどすべての単糖は主に5つまたは6つの炭素環として存在し、カルボニル基とヒドロキシ基の1つとの間の求核付加によって形成されます。
単糖類の環化には重要な意味があります。それは、単糖類がアノマー炭素と呼ばれる新しい不斉中心を獲得することです。特に単純な糖分子が集まってより複雑な糖鎖を形成する場合、単糖類の反応性の中心となります。言い換えれば、糖鎖生物学はその構造的多様性の一部をアノマー炭素に負っているということです。
複雑な糖鎖の形成は、グリコシド結合と呼ばれる結合によって2つの単糖が結合することから始まります。結合は、最初の単糖のアノマー炭素と2番目の単糖のヒドロキシ基の間に形成されます。また、グリコシド結合は、糖鎖と他の生体高分子の間にも起こりうる反応です。
このことについては、この記事の後半で複合糖質について説明します。
オリゴ糖と多糖: 単糖類が手を繋ぐとき
大海原のような広い学問の糖鎖生物学では、有名な単糖は氷山の一角に過ぎません。体内のエネルギー需要をまかなうだけでなく、オリゴ糖(oligosaccharides)や多糖類(polysaccharides)といった複合糖質の構成要素として機能することがよくあります。
オリゴは少数を、ポリは多数を意味し、どちらの単語もギリシャ語に由来しています。名前のとおり、オリゴ糖には2~10個の単糖が含まれています。それ以上の糖鎖は多糖類と考えることができます。
前項で述べたように、糖分子はグリコシド結合を介してつながっています。2つの糖分子をつなぐ方法は1つではありません。実際には、糖の選択だけでなく、糖の結合方法によっても幅広い可能性があります。1つの糖のアノマー炭素は、修飾されていないヒドロキシ基のいずれにも結合できます。さらに、アノマー炭素は立体異性を持ちうる(異なる置換基を持つ)ため、グリコシド結合が異なる配座(つまり、α-またはβ-)を取りえることを意味します。
要点は次のとおりです。結合の多様性は驚くべき構造的・機能的多様性につながり、体内のいくつかの重要な生物学的プロセスの基礎を築きます。
オリゴ糖は、自然界では単独の分子としてはほとんど見られないため特に興味深いです。その代わりに、オリゴ糖はグリコシド結合を介してタンパク質や脂質に結合しており、複合糖質と呼ばれます。これらの糖タンパク質と糖脂質は細胞表面に存在し、細胞間相互作用、接着、シグナル伝達において重要な役割を果たします。当然のことですが、これらの形成や集団における異常は、先天性疾患、エイズ、コロナウイルス感染症、関節リウマチ、がん、炎症性腸疾患などの病態と関連しています1。
多糖類は、まったく別の理由から人体にとって同様に重要です。多糖類はいくつかの食品に含まれていますが、私たちの消化器官では消化できません。私たちの体内の微生物群の数は、私たち自身の細胞よりも数倍多く、私たちの健康に重要な役割を果たしていることが知られています。セルロース、レジスタントスターチ、ペクチンなどの多糖類(主に植物性食品に含まれる)の摂取不足は、腸内細菌叢のバランスを崩します。このバランスの乱れは、糖尿病、肥満、がんなどのいくつかの病気としばしば関連しています2。
グリコシル化:細胞機能の舞台裏
前節で少し触れた複合糖質に焦点を当ててみましょう。最も単純な単細胞生物からヒトに至るまで、すべての細胞は、表面タンパク質と脂質に結合した糖鎖(オリゴ糖と多糖の総称)の層で密に覆われています。これらの構造は、細胞間相互作用、細胞膜を介した分子伝達、細胞シグナル伝達、および細胞運命の決定を容易にします。
粘液や唾液を例に挙げてみましょう。病原体との闘いに欠かせないこれらの体液には、ムチン(mucin)と呼ばれる高密度に糖が付加されたタンパク質が豊富に含まれています3。
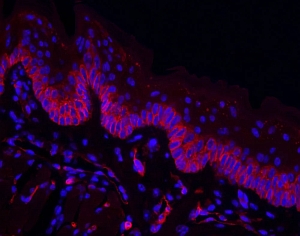
Dylight594標識Griffonia simplicifoliaレクチンを用いたマウス舌の染色像
糖の付加、つまりグリコシル化にはいくつかの種類があります。真核生物で一般的に観察されるのはN-グリコシル化とO-グリコシル化です。NとOは糖鎖が結合している原子を示します。
ここで重要なことは、結合形成のメカニズムは部位特異的なパターンに従うということです。すなわち、特にタンパク質のグリコシル化では、特定のアミノ酸残基がグリコシド結合に有利に作用します。N-結合型グリコシル化では、糖鎖は窒素原子だけでなく、アスパラギン(Asn)残基のアミド基上の窒素原子とも共有結合します。O-グリコシル化では、糖分子のアノマー炭素とセリン(Ser)またはスレオニン(Thr)残基の酸素との間で結合が起こります。
グリコシル化は、タンパク質や脂質に糖鎖が付け加えられることで、この反応により新しい糖が付加されて鎖が伸長します。この伸長は直鎖または分岐状の経路をたどり、最終的分子全体に構造的および機能的多様性をもたらします。
グリコシルトランスフェラーゼ:グリコシル化の原動力
グリコシル化は吸熱性であり、結合の切断・形成過程にはエネルギーが必要です。グリコシルトランスフェラーゼと呼ばれる酵素群は、分子が活性化障壁を乗り越えるための「はしご」を提供し、反応を促進させます。この反応は、糖のタンパク質/脂質への最初の転移か、付加的な糖残基を介した糖鎖部分の伸長かでおきます。
グリコシルトランスフェラーゼは糖を付加し、付加される単糖は、通常ヌクレオチド糖として提示され、糖はヌクレオチドに結合して活性化グリコシル供与体を形成します。この得意い的な形により、糖残基が作用(この場合は反応)できる状態になります。
糖が付加される分子はアクセプターと呼ばれ、最初の付加ではアクセプターはタンパク質またはペプチドです。次のグリコシル化では、主糖鎖がアクセプターとして機能します。
グリコシル化は、グリコシルトランスフェラーゼによって、複雑ですがよく調整された反応に従い行われます。まず第一に、多くのグリコシルトランスフェラーゼは、アクセプターとドナーに対して特異性を持っています。さらに、グリコシルトランスフェラーゼは逐次的に作用し、ある糖転移の産物が次の糖転移のアクセプターとなります。この現象は、異なる細胞種間で顕著な糖鎖構造やグリコシルトランスフェラーゼの発現が異なることを意味しています。
グリコシルトランスフェラーゼは細胞の糖鎖組成を担っているので、その発現の変化が疾患の主な指標となることは当然です。特にがんでは、グリコシルトランスフェラーゼの発現が変化すると異常な糖鎖構造が生じ、細胞のライフサイクルが阻害されます。最終的には、細胞は不死化し、余分な栄養を必要とし、無秩序に分裂し、転移しやすくなります。
実際、異常なグリコシルトランスフェラーゼの発現はさまざまながん種で検出されており、現在ではがんバイオマーカー探索の重要な特徴として用いられています。
次なる課題:糖鎖認識
糖鎖生物学の議論を締めくくる前の最後の用語は、糖鎖の認識に関するものです。何が糖鎖と相互作用するのかを正確に知らなければ、糖鎖の機能を予測することは不可能です。
特定の糖鎖配列を認識するレクチン(lectin)と総称されるタンパク質があります。レクチンは動物だけでなく植物や原核生物にも存在します。
グリコシルトランスフェラーゼと同様に、レクチンも糖鎖認識ドメイン(Carbohydrate Recognition Domain、CRD)が異なるため特異的です。この認識パターンが、糖鎖を持つ細胞とレクチンを持つ細胞との細胞間相互作用を促進します。このような細胞間相互作用は、食作用、アポトーシス、病原体との結合、細胞運動(接着や遊走など)の制御といった免疫応答の「鍵」となります。
レクチンには、特定の糖鎖構造を認識する能力があるため、糖鎖生物学研究、特にがん細胞における糖鎖検出の期待の新星となっています。興味深いことに、レクチンは動物性だけではありません。実は、植物レクチンが今日のがん研究における糖鎖検出の主要な情報源なのです。不可解に聞こえますよね。植物由来のタンパク質が、どうしてヒトの糖鎖プロファイルのマッピングに使えるのでしょうか。
これについてはまた別の機会に譲ります。次回のブログ「レクチン101:がんバイオマーカー探索を植物のレクチンが加速させる方法」では、レクチン、特に植物レクチンについて掘り下げ、糖鎖研究におけるレクチンの魅力について探ります。
レクチンガイドのご案内
レクチンの歴史、レクチンアッセイの方法、原理などについては、以下のレクチンガイド(Lectin Application and Resource Guide)もあわせてご参照下さい。
参考文献
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。



