細胞透過性のライブセルイメージング用蛍光プローブ Spirochrome バイオイメージング用色素
掲載日情報:2023/10/05 現在Webページ番号:69536
Spirochrome社が開発した細胞透過性の生細胞イメージングプローブで、ライブセルで微小管、F-アクチン、リソソーム、染色体DNA、SNAPタグ融合タンパク質を染色できます。これらの蛍光プローブは、Nature MethodsおよびNature Chemistryに掲載論文で紹介され、またJournal of Biological Chemistryの表紙にも取り上げられました。
※ 生細胞中のF-アクチン/DNA/チューブリン/SNAPタグ融合タンパク質を検出できる蛍光プローブ:SPY Probesの詳細についてはこちらをご覧下さい。
※ 本製品は研究用です。研究用以外には使用できません。
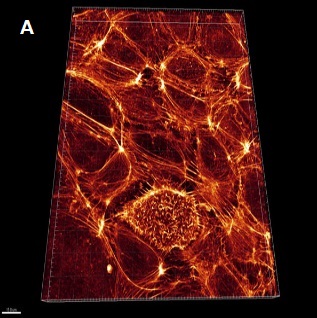
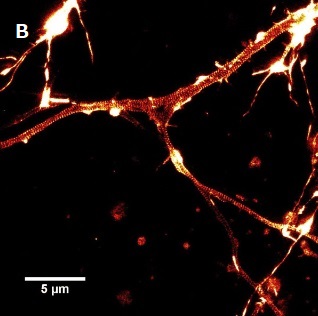
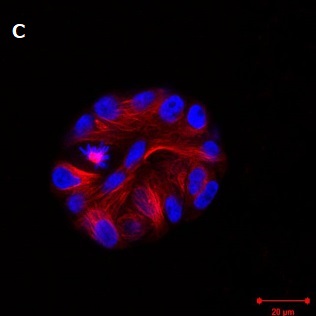
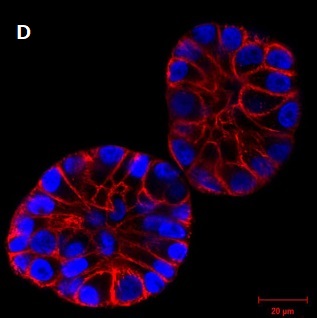
画像提供
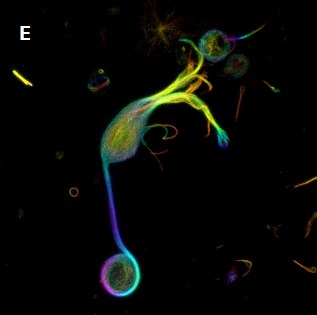
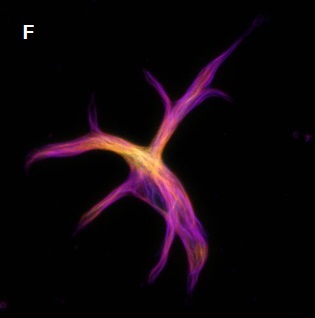
- A:Urim Retkoceri and Steffen Dietzel, Ludwig-Maximilians Universitat, Munchen.
- B:Elisa D'Este, MPI Biophysical Chemistry, Göttingen.
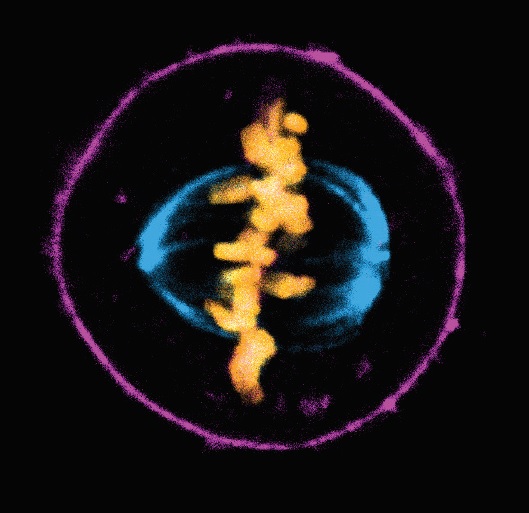
- C、D:Christian Conrad and Katharina Jechow, Heidelberg.
- E、F:Justin W. Taraska, Laboratory of Cellular Biophysics, NIH, Bethesda.
追加しました。
技術情報:有糸分裂紡錘体の視覚化の新しいツール
有糸分裂紡錘体についての背景情報
細胞分裂はすべての生物に共通する生命現象であり、有糸分裂紡錘体は、有糸分裂において染色体をそれぞれの娘細胞に能動的かつ正確に分割するという非常に重要な役割を担っています。有糸分裂紡錘体は、中心体から染色分体の動原体に付着する動原体微小管束(別名:動原体繊維)として観察されます。
しかしながら、有糸分裂紡錘体機能を調節する分子メカニズムは、以下の理由で解明することが非常に困難でした1、2)。
- 数百から数千の微小管で構成されている、非常に大きくて複雑な構造であるため。
- 非常に動的な構造体であるため。
- 有糸分裂紡錘体の形成と機能に関与する微小管関連タンパク質(MAP)が多数あるため。
近年の微小管視覚化ツールの発展により、研究者は「有糸分裂紡錘体形成の時間/空間的メカニズム」、「紡錘体が発する力」および「紡錘体と動原体複合体との相互作用」をより理解できるようになりました。
微小管(MT)は、チューブリンのαβ-ヘテロダイマーによって形成されます。MTの顕著な特性は動的不安定性であり、錘体形成および有糸分裂を含む、細胞内のその多くの機能において重要な役割を果たしています。MT機能の研究は、その動的な特性ゆえに困難でしたが、濁度測定、DIC顕微鏡法、および蛍光標識チューブリンを用いたTIRF顕微鏡法といったin vitroの解析手法により、MTの成長速度、収縮速度、重合状態から脱重合状態への移行(catastrophe)率、および脱重合から重合への移行(rescue)率は、より良く理解できるようになりました3)。
一方、細胞内におけるMT機能の研究では、細胞内のチューブリンを標識することにより、結合特性や関連するタンパク質との相互作用および動的調節に影響を与える可能性があるため、in vitro解析とは異なる難しさがあります。例えば、細胞内で蛍光タンパク質融合チューブリンを過剰発現させた場合、チューブリン重合による立体障害が起こり、全体的なバックグラウンドシグナルが高くなることがよくあります。この問題を回避し、動的な観察を可能にするために、スペックル法(一定量の蛍光標識チューブリンを細胞にマイクロインジェクションするか、チューブリンの特定のアイソフォームをGFP融合タンパク質として発現させることにより、チューブリンの一部のみを蛍光標識する)というアプローチが使用されます。最近、SiRチューブリンと呼ばれる新しい蛍光標識チューブリン特異的プローブが、その特異性、細胞透過性および蛍光特性のために大きな関心を集めています4)。
以下は、SiRチューブリンプローブがどのように有糸分裂紡錘体研究に貢献しているかを示す3つの事例です。
① 有糸分裂紡錘体が発する力を理解する
その中期に染色体が赤道面に集結し、後期で両極に向かって移動する有糸分裂では、特別な力が必要であり、いくつかの研究により、有糸分裂紡錘体が発する力がモータータンパク質によって生み出されることが明らかになりました。さらに、Novakらの最近の研究では、モータータンパク質kinesin-5が力を生み出すだけでなく、有糸分裂紡錘体に回転力を与えることが発見されています5)。
SiRチューブリンプローブを用いた誘導放出抑制(STED)超解像顕微鏡法により、中期紡錘体のMT束の形状が観察され、MTが湾曲した形状やS形状を含む様々な形状に配置されていることが示されました。また、PRC1-GFP融合タンパク質を発現させて動原体繊維を標識した細胞を、共焦点顕微鏡で観察し、動原体繊維の画像を再構築(Z-stack)することで、有糸分裂紡錘体が左巻きMT束の非対称(キラル)構造物であることが示されました。
有糸分裂阻害物質であるS-trityl-L-cysteinによりkinesin-5が不活化されると、有糸分裂紡錘体の左巻き構造が緩やかになることも確認されており、回転力が有糸分裂紡錘体の形成と機能に果たす役割の解明は、非常に興味深いものです。
② 紡錘体形成の時間/空間的メカニズムを理解する
紡錘体の形成は、細胞骨格ネットワーク、分子モーター、および核によって調整されます。近年、Nunesらはこのプロセスを時空間的に調査し、効率的な紡錘体形成に必要な、いくつかの重要なメカニズムを特定しました6)。
この複雑なプロセスを調査するために、高解像度イメージングと3D再構成によるマイクロパターニングが使用され、中心体は細胞分裂前期の核膜が破壊された時に、核の最も短い軸上に配置されることがわかりました。この配置場所は有糸分裂が正確に実行されるかどうかに影響を与える可能性があるため重要です。
さらに彼らは、アクチン関連タンパク質Arp2 / 3と分子モーターであるダイニンが、この中心体の挙動の重要な調節因子であることを示しました。
SiRチューブリンプローブは、紡錘体チェックポイントが中心体の配置によって影響を受けるかどうかを判断するための実験に不可欠でした。核の最も短い軸上に配置された中心体が、紡錘体チェックポイント分子であるMad2を早期に除去することで、有糸分裂がタイムリーに進行することが示されました。
③ 動原体カップリングを調節するための動原体タンパク質のリン酸化
動原体は有糸分裂の重要な構造です。Longらは、細胞分裂中期における動原体と重合MT束および解離MT束の相互作用を調節するメカニズムを解明しようとしました7)。動原体微小管結合部の構成要素であるHec1タンパク質のテールドメインは、Aurora B kinaseによるリン酸化を受けます。興味深いことに、Hec1のテールドメインのリン酸化状態の変化は、解離MT束との結合能には影響を与えませんが、重合MT束との間では、摩擦を調整し、MT束との結合能に影響を与えることがわかりました。
SiRチューブリンプローブは、Hec1ホスホミメティック(リン酸化模倣)がMTとの相互作用を変化させたかどうかを検証するための実験で使用されました。
まとめと今後の展望
これらの研究では、紡錘体の形成と機能をより明確に検証するために、既存の手法と組み合わせて、SiRチューブリンプローブが使用されました。また、これらの研究は、紡錘体の重要なメカニズムを制御する微小管関連タンパク質(MAP)の重要性を強調しています。
1975年にGreenbergらによってMAPが同定されて以来8)、プロテオミクス解析や機能研究によって有糸分裂紡錘体の形成および機能に関与する200以上のタンパク質が同定されてきました1)。超解像顕微鏡を使用して、有糸分裂紡錘体の動的調節におけるMAPの役割をさらに深く掘り下げていくにために、優れた生細胞イメージングツールが必要とされています。GFP融合タンパク質は確立された手法ですが、光毒性とS / N比の問題があり、特に蛍光プローブが好まれる一分子顕微鏡や超解像顕微鏡法では制限要因となる可能性があります。
GFP以外の融合タンパク質システムとしてはSNAPタグ標識システムがあります。このシステムではベンジルグアニン(BG)結合蛍光色素でSNAPタグ融合タンパク質を特異的に標識することができます9 )。しかしながら、すべてのBG結合プローブが同じように作製されるわけではなく、最近の研究では、これらのプローブの多くが急速な光退色と非特異的染色をもたらすことが示されました10 )。
Cytoskeleton社は、SiRおよびSPYチューブリンプローブに使用され、非常に好評な細胞透過性の蛍光色素である、SiR650、SiR700、SPY555およびSPY620にBGを結合した、超解像顕微鏡法で使用可能なSiR-BGおよびSPY-BGの販売を開始しました。
SiR-BGおよびSPY-BGと、SiRおよびSPYチューブリンプローブは、確立された細胞膜透過性蛍光色素でチューブリンとMAPの両方を蛍光標識することができる、有糸分裂紡錘体の研究に有用なツールです。
参考文献
- Petry, S., "Mechanisms of Mitotic Spindle Assembly", Annu. Rev. Biochem., 85, 659~683 (2016). (Review) [PMID:27145846]
- McIntosh, J.R., "Mitosis", Cold Spring Harb. Perspect. Biol., 8 (9), (2016). (Review) [PMID:27587616]
- Zwetsloot, A.J., et al., "Measuring microtubule dynamics", Essays Biochem., 62 (6), 725~735 (2018). (Review) [PMID:30287587]
- Lukinavičius, G., et al., "Fluorogenic probes for live-cell imaging of the cytoskeleton", Nat. Methods, 11 (7), 731~733 (2014). [PMID:24859753]
- Novak, M., et al., "The mitotic spindle is chiral due to torques within microtubule bundles", Nat. Commun., 9 (1), 3571 (2018). [PMID:30177685]
- Nunes, V., et al., "Centrosome-nuclear axis repositioning drives the assembly of a bipolar spindle scaffold to ensure mitotic fidelity", Mol. Biol. Cell., 31 (16), 1675~1690 (2020). [PMID:32348198]
- Long, A.F., et al., "Hec1 Tail Phosphorylation Differentially Regulates Mammalian Kinetochore Coupling to Polymerizing and Depolymerizing Microtubules", Curr. Biol., 27 (11), 1692~1699 (2017). [PMID:28552353]
- Sloboda, R.D., et al., "Cyclic AMP-dependent endogenous phosphorylation of a microtubule-associated protein", Proc. Natl. Acad. Sci. USA, 72 (1), 177~181 (1975). [PMID:164013]
- Keppler, A., et al., "A general method for the covalent labeling of fusion proteins with small molecules in vivo", Nat. Biotechnol.., 21 (1), 86~89 (2003). [PMID:12469133]
- Bosch, P.J., et al., "Evaluation of fluorophores to label SNAP-tag fused proteins for multicolor single-molecule tracking microscopy in live cells", Biophys. J., 107 (4), 803~814 (2003). [PMID:25140415]
追加しました。
特長
追加しました。
製品ラインナップ・価格
 をクリックすると製品の詳細、商品コードをクリックすると各製品の価格表をご覧いただけます。
をクリックすると製品の詳細、商品コードをクリックすると各製品の価格表をご覧いただけます。
| 品名 | 測定波長 | 標的因子/商品コード | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 励起 (nm) |
蛍光 (nm) |
Actin | DNA | Lysosome | Tubulin | SNAPタグ 融合タンパク質 |
Cell membrane tension |
HaloTag | |
| SiR Kit | 652 | 674 | CY-SC001  |
CY-SC007  |
CY-SC012  |
CY-SC002  |
- | - | - |
| SPY505 | 512 | 531 | - | CY-SC101  |
- | - | - | - | - |
| SPY555 | 555 | 580 | CY-SC202  |
CY-SC201  |
- | CY-SC203  |
CY-SC204  |
- | CY-SC206  |
| SPY555-FastAct | 555 | 580 | CY-SC205  |
- | - | - | - | - | - |
| SPY595 | 599 | 615 | - | CY-SC301  |
- | - | - | - | - |
| SPY620 | 619 | 636 | CY-SC402  |
CY-SC401  |
- | - | CY-SC404  |
- | - |
| SPY650 | 652 | 674 | - | CY-SC501  |
- | CY-SC503  |
- | - | - |
| SPY650-FastAct | 652 | 674 | CY-SC505  |
- | - | - | - | - | - |
| SiR650 | 652 | 674 | - | - | - | - | CY-SC504  |
- | - |
| SPY700 | 696 | 718 | - | CY-SC601  |
- | - | - | - | CY-SC606  |
| SPY700-FastAct | 696 | 718 | CY-SC605  |
- | - | - | - | - | - |
| SiR700 Kit | 689 | 716* | CY-SC013  |
CY-SC015  |
CY-SC016  |
CY-SC014  |
CY-SC604  |
- | - |
| Flipper-TR Kit for fluorescence cell membrane microscopy | 488 | 600 | - | - | - | - | - | CY-SC020  |
- |
* SiR700 BG(#CY-SC604)は718 nm。
追加しました。
関連ニュースレター
Cytoskeleton社のニュースレターをダウンロードできます。
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。