HOME
>
試薬
>
細胞培養
>
細胞の解析
>
細胞生存率/細胞毒性/多剤耐性
>
CellFluor® GST
HOME
>
試薬
>
タンパク質/酵素
>
タンパク質解析
>
酵素活性測定キット
>
CellFluor® GST
HOME
>
試薬
>
創薬研究
>
exploratory_research
>
薬理研究・薬物動態
>
CellFluor® GST
HOME
>
試薬
>
細胞培養
>
細胞の解析
>
細胞の染色/トレーサー
>
CellFluor® GST
生細胞ハイスループットスクリーニングに最適なGST活性測定試薬 CellFluor® GST
掲載日情報:2023/07/20 現在Webページ番号:68115

フナコシ /
フナコシ株式会社
[メーカー略称:FNA]
生細胞に適用できるGlutathione S-transferase(GST)の酵素活性応答性蛍光プローブです。細胞内に迅速に取り込まれ、細胞内GSTにより緑色蛍光を発するため、生細胞レベルでのGST活性の評価に有用です。測定前の洗浄も不要で、培地に試薬を添加するだけのプロトコルのため、蛍光プレートリーダーを用いたハイスループットスクリーニングを簡便に構築することができます。細胞・組織ライセートなどのin vitroアッセイにも使用でき、さらに従来試薬に比べて検出感度が高いという利点もあります。
※本製品は研究用です。研究用以外には使用できません。
製品名変更のお知らせ
本製品は、以下のとおり製品名を変更いたしました。
※ なお、製品仕様、商品コード、価格、容量に変更はございません。
- 旧品名:DNs-Rh
- 新品名:CellFluor® GST
図をクリックすると拡大します( )
)
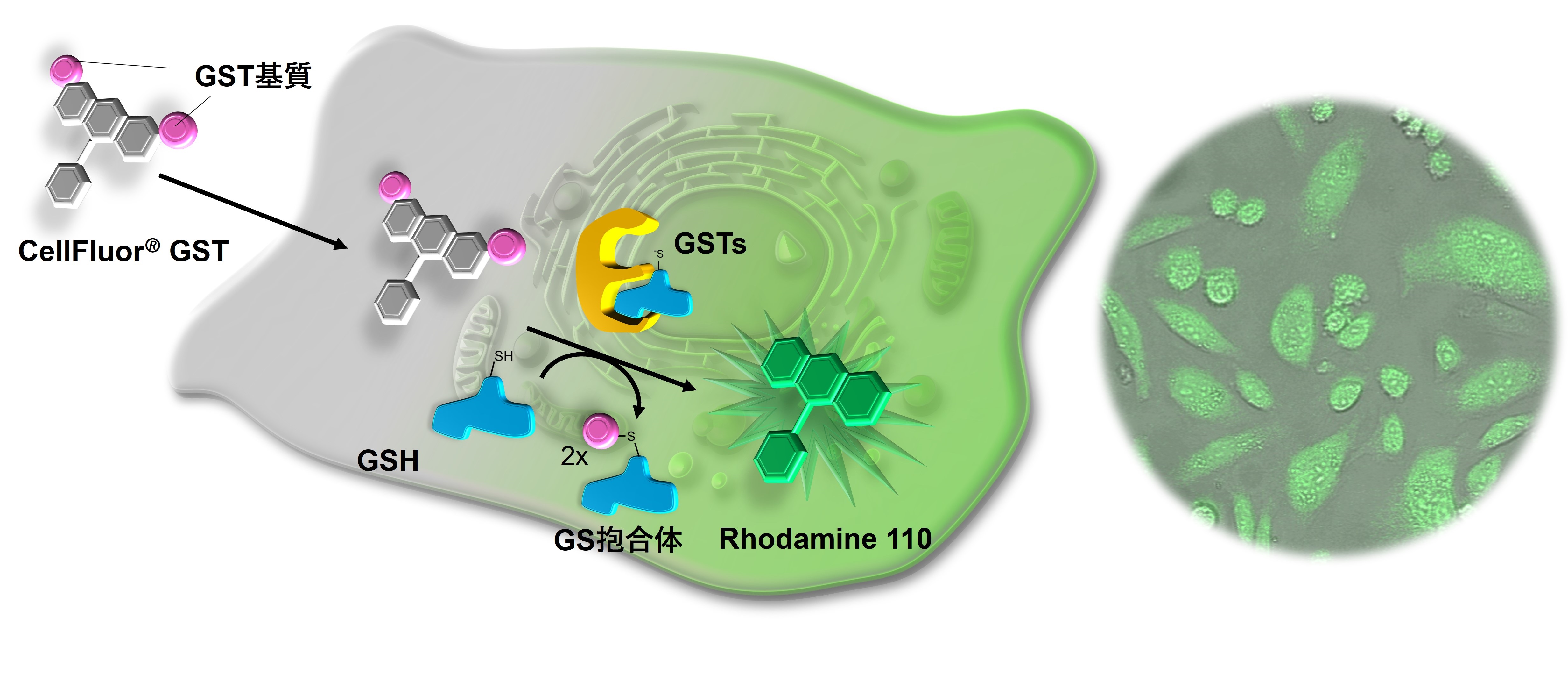
CellFluor® GST概要図
CellFluor® GSTは、Rhodamine110にGST応答性保護基を導入した無蛍光性化合物で、優れた細胞透過性を有する。また、細胞内において各種GSTによって保護基が除去されることによりRhodamine110の緑色蛍光を生じる。蛍光プレートリーダーや蛍光顕微鏡観察により緑色蛍光強度を測定することで、生細胞レベルでのGST活性を評価することができる。
追加しました。
GSTとその活性測定手法について
GSTについて
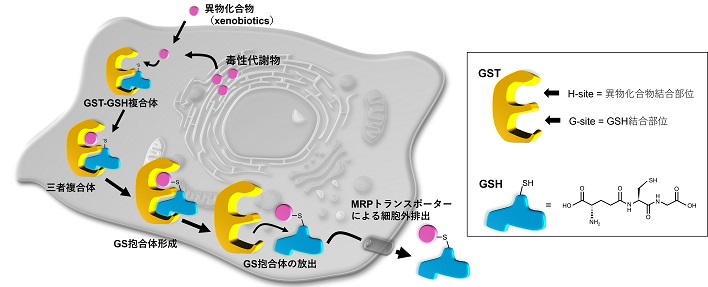
Glutathione S-Transferase(GST)ファミリーは、バクテリアから動物、植物まで幅広く保存されている酵素ファミリーで、第Ⅱ相薬物代謝酵素の1つです。第Ⅰ相薬物代謝酵素シトクロムP450により細胞内で産生された求電子代謝物や、細胞外から取り込まれた異物化合物(xenobiotics)をグルタチオン(Glutathione; GSH)に付与し、グルタチオン抱合体(GS抱合体、GS-conjugate)に変換する活性を有しています。グルタチオン抱合体は、多剤耐性関連タンパク質(Multidrug resistance-associated proteins;MRP)トランスポーター群により積極的に細胞外に排出され、毒性を軽減させる機構が存在します。そのため、GSTは細胞毒となりうる代謝物質や異物化合物の排出にかかわる解毒因子として機能すると考えられています。細胞内の主たる抗酸化因子として、酸化ストレスや脂質過酸化反応の抑制にも寄与すると考えられています。
一方、多くの抗がん物質などの医薬品はGSTの基質となりうることから、GSTによりグルタチオン抱合体に変換されて細胞外に排出されるケースが報告されています。また、GSTは薬効を低下させる薬剤耐性効果も示します。特に、がんの悪性化にともない特定のGSTアイソフォーム(GSTP1)の発現量が亢進することが知られ、それによりがん細胞は薬剤耐性を獲得すると考えられています。
図をクリックすると拡大します( )
)
細胞内でのGSTの作用機構
GSTの活性測定における問題点とCellFluor® GSTについて
このように、GSTは第Ⅱ相薬物代謝酵素として抗酸化因子、異物代謝・解毒作用因子、薬剤耐性因子と多機能を有することから、生細胞におけるGST活性の測定技術が求められています。しかし、従来のGST活性の測定は、細胞ライセートを用いたin vitroアッセイによる方法に限られていました。CellFluor® GSTは、細胞膜透過性を有する低分子化合物であり、GSTの活性により緑色蛍光を生じるGST活性応答性プローブです。in vitroアッセイのみならず生細胞アッセイで使用できることから、蛍光プレートリーダー、蛍光イメージング、フローサイトメトリーなど各種細胞ベース蛍光アッセイ(Cell-based fluorescent assay)に適用でき、生細胞でのGST活性の定量比較や刺激依存的なGST活性のモニタリングが可能です。また、蛍光プレートリーダーを用いることで、生細胞ベースでハイスループットなGST阻害物質探索にも有用です。
GST活性測定用プローブの比較
商品コードをクリックすると価格表をご覧いただけます。
| プローブ名 | CellFluor® GST (本製品) |
CDNB (従来法) |
||
|---|---|---|---|---|
| 商品コード | FDV-0030 | - | ||
| 測定方法 | 緑色蛍光 | UV | ||
| 測定波長 | 励起 496 nm/蛍光 520 nm | ~340 nm | ||
| 測定対象 | 広範なGSTファミリー | |||
| 実験系 | in vitro (ライセートや精製酵素など) |
可 | 可 | |
| 生細胞 | 蛍光プレートリーダー | 可 | 不可 | |
| イメージング | 可 | 不可 | ||
| フローサイトメトリー | 可 | 不可 | ||
| 測定感度 | 高い (蛍光のため) |
低い (UV吸収のため) |
||
| ハイスループット性・簡便性 | 高い (生細胞のまま観察可能で、洗浄操作も不要) |
低い (ライセート調製が必要) |
||
| 他の因子との同時測定 | 可 (青色蛍光や赤色蛍光を併用可能) |
困難 | ||
追加しました。
原理
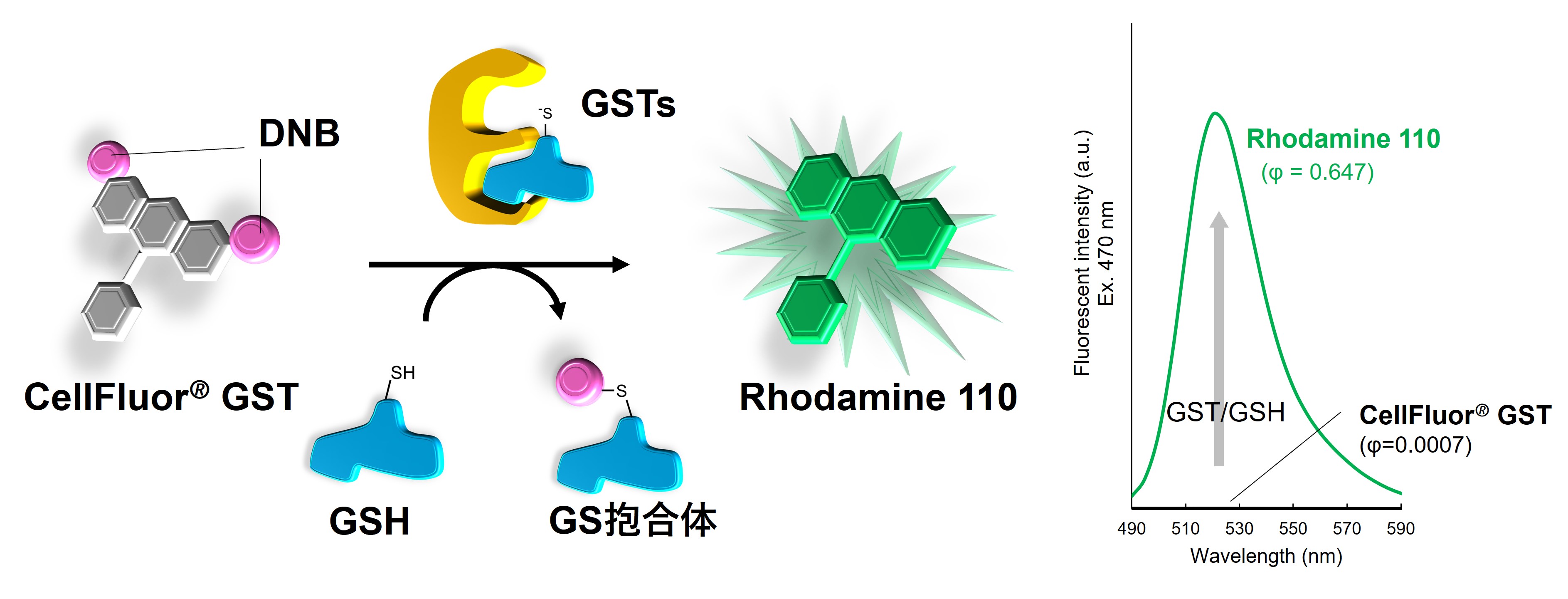
CellFluor® GSTは、幅広いGSTの基質である2,4-dinitrobenezensulfonamide(DNB)を緑色蛍光色素Rhodamine 110に2つ付加した化合物で、通常は消光状態になっています(量子収率 0.0007)。GSTによりDNB基が外れてグルタチオン抱合体に変換されると、Rhodamine110(量子収率 0.647)が放出され、緑色蛍光(励起極大波長 496 nm/蛍光極大波長 520 nm)を発します。
CellFluor® GST(原著論文名 bis-DNs-RhまたはDNs-Rh)は、当初チオール基(-SH)を検出する試薬として開発されましたが、その後の解析によりGST活性の検出試薬として有効であることが分かりました。チオール基に対する応答性に比べGSTに対する応答性が著しく高いことから、CellFluo® GSTは生細胞用のGST活性測定プローブとして利用できます。細胞質型GST(GSTA、GSTM、GSTP、GSTO、GSTT、GSTZ)、およびミクロソーム型GST(MGST)に応答することが確認されています。
※ 注:各種チオール含有化合物に対しても弱いながら反応性を示します。アッセイバッファー中のチオール含有化合物(GSH、DTTなど)の濃度や反応時間には注意が必要です。
図をクリックすると拡大します( )
)
CellFluor® GSTの原理
生細胞アッセイ系においては、細胞内GSTの酵素活性により産生されたRhodamine 110はミトコンドリアを中心に細胞内に拡散しますが、細胞内滞留性は高くなく徐々に培地中に放出されます。そのため、蛍光プレートリーダーを用いる測定においては、CellFluor® GST添加後の培地交換を行わずにそのまま蛍光強度を測定することを推奨します。一方で、各種蛍光顕微鏡観察の場合では、培地中に放出されたRhodamine 110が観察時のバックグラウンドになる可能性もあり、洗浄後に速やかに観察することを推奨します。
追加しました。
特長
- GST活性によってRhodamine 110が放出され緑色蛍光を発します(Ex 496 nm/Em 520 nm)。
- 生細胞アッセイ(蛍光プレートリーダー、蛍光イメージング、フローサイトメトリー)、およびin vitroアッセイ(精製酵素、細胞/組織ライセートなど)にも使用できます。
- in vitroアッセイでは、従来のCDNBアッセイに比べて高い検出感度を示します。
- 生細胞アッセイでは、細胞膜透過性により培地に添加するだけで使用できます。また、GSTの応答前後において高いSN比(量子収率比~900倍)を示すため、洗浄操作を必要とせずに測定できます。
- さまざまなGSTファミリーに対し反応性を示します。
実績のあるGSTサブファミリー
- GSTα(GSTA1、GSTA2、GSTA3、GSTA4)
- GSTμ(GSTM1、GSTM2)
- GSTπ(GSTP1)
- GSTω(GSTO1)
- GSTθ(GSTT1)
- GSTζ(GSTZ1)
- MGST(MGST1)
※ 組換え体GSTO1およびGSTT1の精製タンパク質を用いた解析では、他の細胞質型GST(GSTA1、GSTM1、GSTP1、GSTZ1)に比べて活性が弱いことが認められています。
スペクトルデータ
|
|
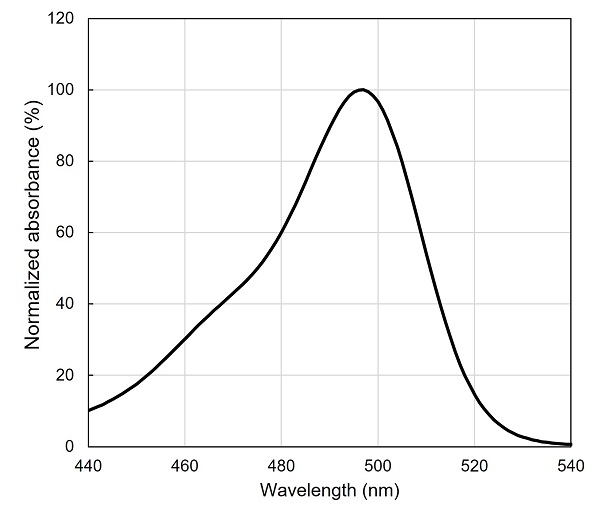
Rhodamine 110の吸収スペクトル |
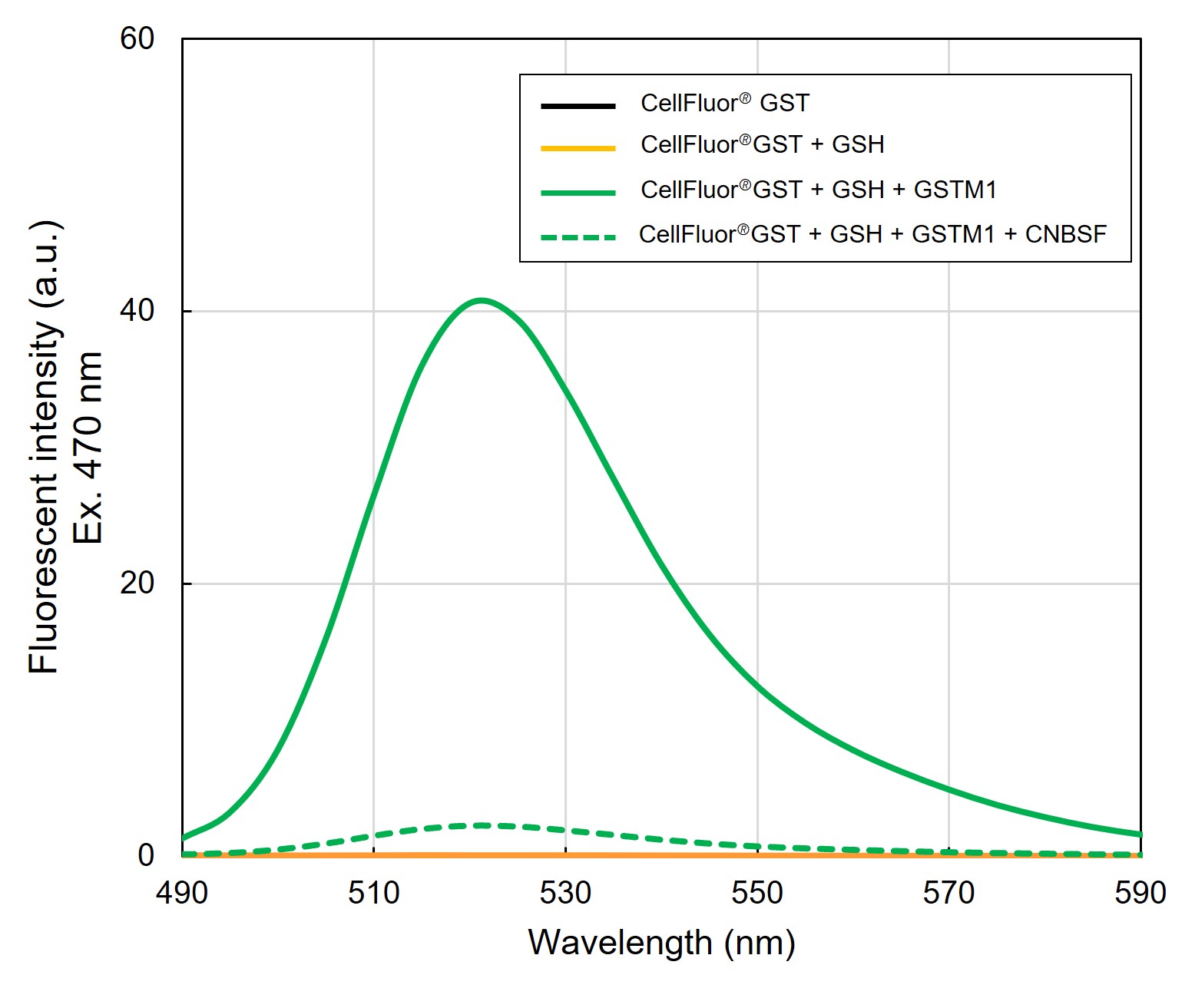
CellFluor® GSTのGST応答性蛍光スペクトル |
図をクリックすると拡大します( |
|
- 左:吸収極大:495 nm
- 右:アッセイバッファー(50 mM sodium phosphate(pH 7.4), 150 mM NaCl)を使用し、励起光470 nmにおけるCellFluor® GST(1 μM)の蛍光スペクトルを測定した。CellFluor® GST単体および10 μM GSH存在下では蛍光は観察されなかったが、ヒト組換え体GSTM1(0.5 μg/ml)添加時において520 nm付近に極大を持つ蛍光が観察された。また、GSTM1、GSHおよびGST阻害物質☞ CNBSF(100 μM)で前処理した場合では、この蛍光が著しく抑制されることが観察された。
追加しました。
使用例
組換え体GSTタンパク質を用いたin vitroアッセイ
※ 細胞質型GSTサブメンバーGSTA1、GSTP1、GSTO1、GSTT1、GSTZ1についても、精製組換え体タンパク質を用いた場合と同様の実験結果が確認されています。GSTO1、GSTT1は、精製組換え体タンパク質の解析においては応答性が弱いことが認められています。
※ CellFluor® GSTは、チオール含有化合物に対しても弱い反応性を示します(☞ 原理参照)。in vitroアッセイ系におけるGSTの活性化にはGSHの添加が必要ですが、GSHの添加量に応じてバックグラウンドを生じるため、適切なネガティブコントロールを設定し、反応時間を検討することを推奨します。
GST含有試料の濃度依存的蛍光応答性の評価
※ 同じ試料を用いて従来のCDNBアッセイ(GSH 1 mM, CDNB 1 mM)を行ったところ、検出限界は1,000 ng/ml程度であった。
生細胞実験系における細胞数依存的な蛍光応答性の評価
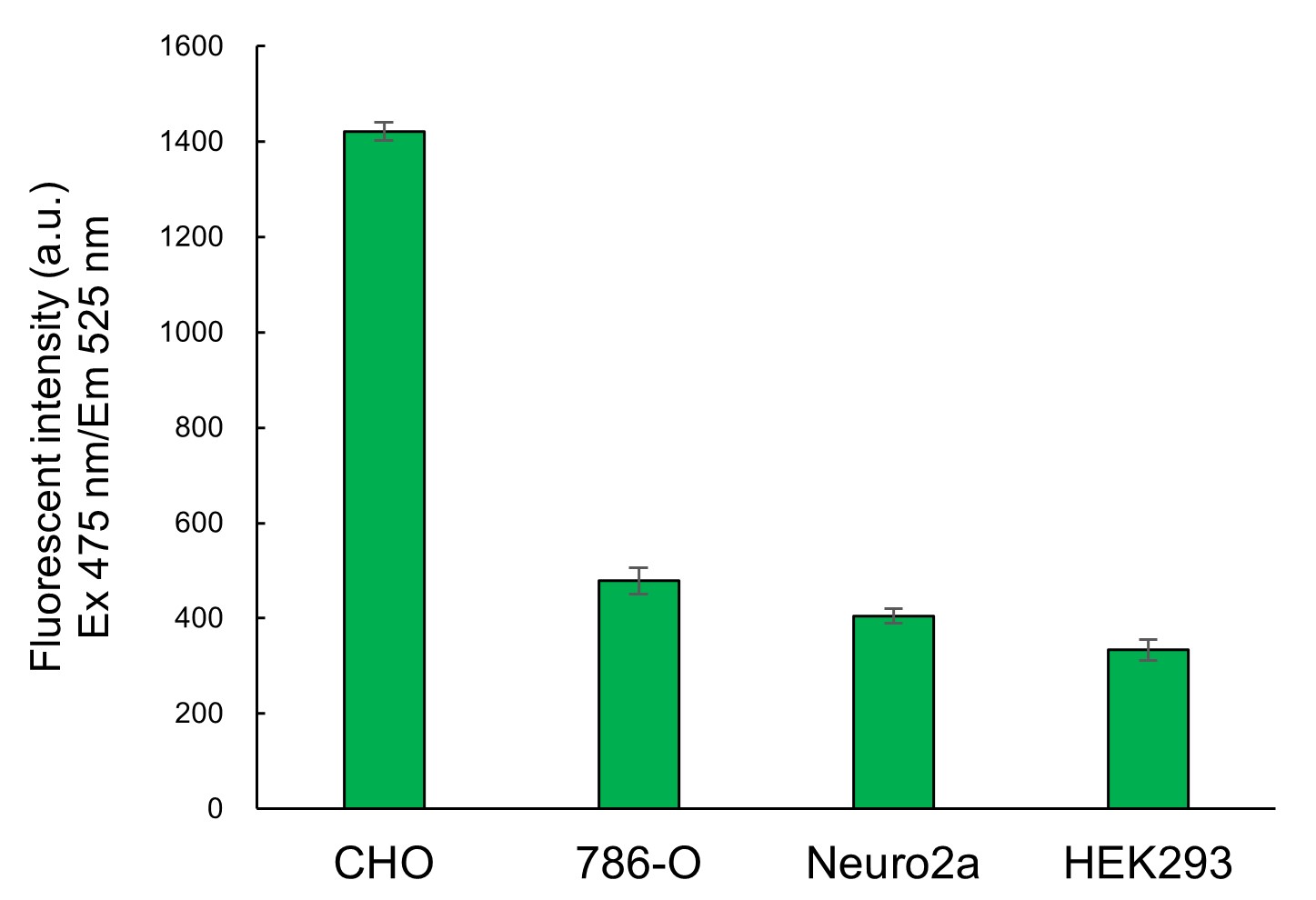
蛍光プレートリーダーによる4種類の細胞株の生細胞GST活性の相対的評価
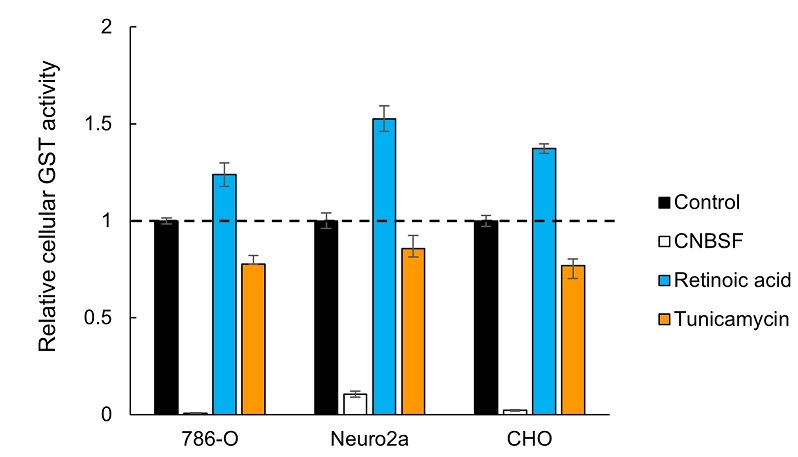
蛍光プレートリーダーによる生細胞GST活性の薬剤応答性評価
蛍光顕微鏡による生細胞イメージング
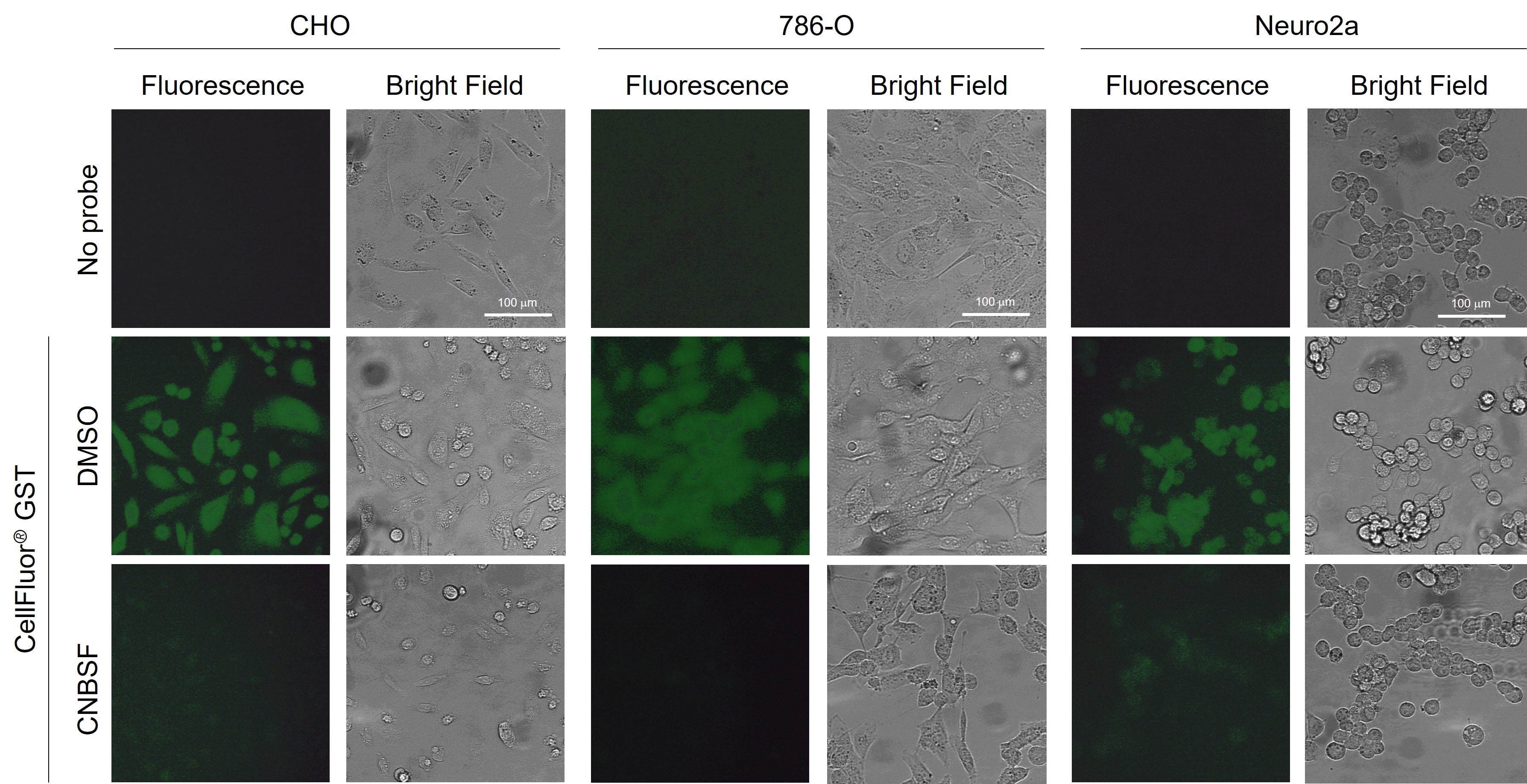
3種類の細胞株(CHO、786-O、Neuro2a)をガラスボトムディッシュに播種し、10% FBS含有DMEM培地で20時間培養した。その後、無血清・フェノールレッド不含のDMEM培地に交換し、CellFluor® GSTを終濃度 30 μMになるように添加し、10分間反応させた。培地を交換し、直ちに落射型蛍光顕微鏡(Ex 435~475 nm/Em 530~543 nm)で観察した。いずれも細胞内から緑色蛍光シグナルが観察された。一方、事前にGST阻害物質である☞ CNBSFを処理(100 μM、30分)した場合では、細胞内蛍光が顕著に減弱していることが分かる。
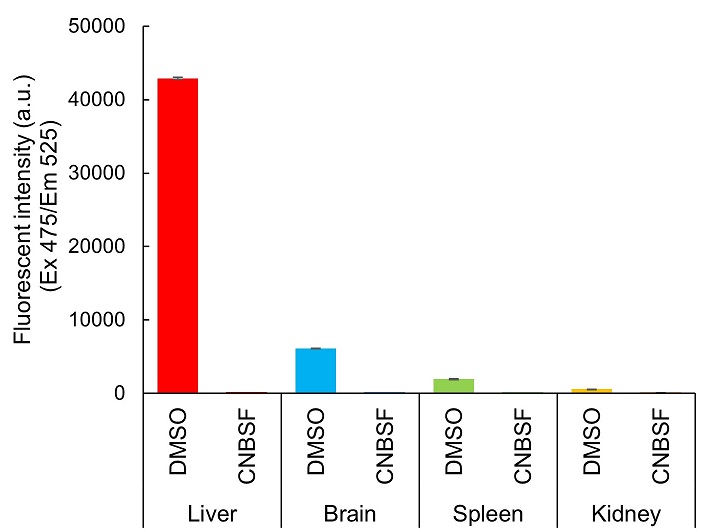
組織ライセートを用いたin vitroアッセイ
追加しました。
参考文献
- Shibata, A., et al., "Rhodamine-based fluorogenic probe for imaging biological thiol.", Bioorg. Med. Chem. Lett., 18(7), 2246~2249(2008). [PMID:18358719]
- Alander, J., et al., "Characterization of a new fluorogenic substrate for microsomal glutathione transferase 1.", Anal. Biochem., 390(1), 52~56(2009). [PMID:19348782]
- Zhang, J., et al., "Synthesis and characterization of a series of highly fluorogenic substrates for glutathione transferases, a general stategy.", J. Am. Chem. Soc., 133(35), 14109~14119(2011). [PMID:21786801]
- Shishido, Y., et al., "A covalent inhibitor for Glutathione S-Transferase Pi (GSTP1-1) in Human Cells.", ChemBioChem., 20(7), 900~905(2019). [PMID:30548113]
追加しました。
価格
[在庫・価格 :2026年02月22日 00時00分現在]
| 詳細 | 商品名 |
|
文献数 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
CellFluor GST <Cell-based GST Activity Assay Reagent> |
|
0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
[在庫・価格 :2026年02月22日 00時00分現在]
CellFluor GST <Cell-based GST Activity Assay Reagent>
文献数: 0
- 商品コード:FDV-0030
- メーカー:FNA
- 包装:0.1μmol
- 価格:¥35,000
- 在庫:3個以上
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | Glutathione S-transferase(GST)の酵素活性を生細胞で観察することができる蛍光プローブ。GST活性に応じて緑色の蛍光が発生するため,細胞内GSTの活性評価に有用。広範なGSTサブファミリーに交差するため,総GST活性を可視化できる。 |
||
|---|---|---|---|
| 法規制等 | |||
| 保存条件 | -20℃,暗所保存 | 法規備考 | |
| 掲載カタログ |
ニュース2025年9月1日号 p.23 ニュース2022年11月15日号 p.20 ニュース2024年2月1日号 p.13
|
||
| 製品記事 | 脂質過酸化研究用製品特集 |
||
| 関連記事 | |||
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。