HOME
>
特集
>
神経科学(Neuroscience)研究用 抗体/タンパク質 (StressMarq Biosciences社)
HOME
>
試薬
>
抗体
>
一次抗体
>
神経科学(Neuroscience)研究用 抗体/タンパク質 (StressMarq Biosciences社)
HOME
>
試薬
>
神経/イオンチャネル
>
神経生理
>
神経伝達/神経修飾関連物質
>
神経科学(Neuroscience)研究用 抗体/タンパク質 (StressMarq Biosciences社)
神経科学(Neuroscience)研究用 抗体/タンパク質 (StressMarq Biosciences社)
掲載日情報:2020/12/22 現在Webページ番号:67227
StressMarq Biosciences社は、モノクローナル抗体、ポリクローナル抗体、標識抗体、タンパク質、低分子化合物、活性型PFF体(Preformed Fibril)など、神経変性の研究を支援する最先端の研究製品の開発に取り組んでいます。
追加しました。
神経科学(Neuroscience)研究用製品ラインナップ
カテゴリー名をクリックすると製品の詳細Web記事をご覧いただけます。
追加しました。
神経科学とは
神経科学は、神経系を横断的に研究する学問です。神経系は、脳と脊髄を含む中枢神経系(CNS)と、CNSをそれ以外の身体とつなぐ神経からなる末梢神経系(PNS)という、主要な二つの部分から構成されています。
中枢神経系は、身体のさまざまな部位と脳との間で情報の送受信を行っており、末梢神経系は自律神経系(交感神経系と副交感神経系から成る)を介して随意運動、不随意機能を制御し、腸神経系を介して消化器系を制御しています。
神経系は、信号の送受信を行う特殊な細胞であるニューロンで構成されています。これらの電気化学信号は、ニューロンの樹状突起で受信され、ニューロンの軸索に沿って伝わります。電気化学信号が軸索の末端に到達すると、軸索と樹状突起の間の接合部に神経伝達物質が放出されます。この接合部はシナプスと呼ばれます。
神経細胞ネットワークはグリア細胞(グリア)によって支えられています。グリアは、ニューロン集団に栄養、恒常性、ミエリン鞘を提供する役割を担っています。
神経科学者は、アルツハイマー病やパーキンソン病などの神経疾患をより深く理解し、効果的な治療法や治療法を提供するための研究を推進しています。StressMarq社では、モノクローナル抗体、ポリクローナル抗体、抗体コンジュゲート、タンパク質、免疫測定法、低分子阻害物質、活性なPFF体(Preformed Fibril)など、神経変性の研究に役立つ最先端の研究製品の開発に取り組んでいます。
追加しました。
使用例
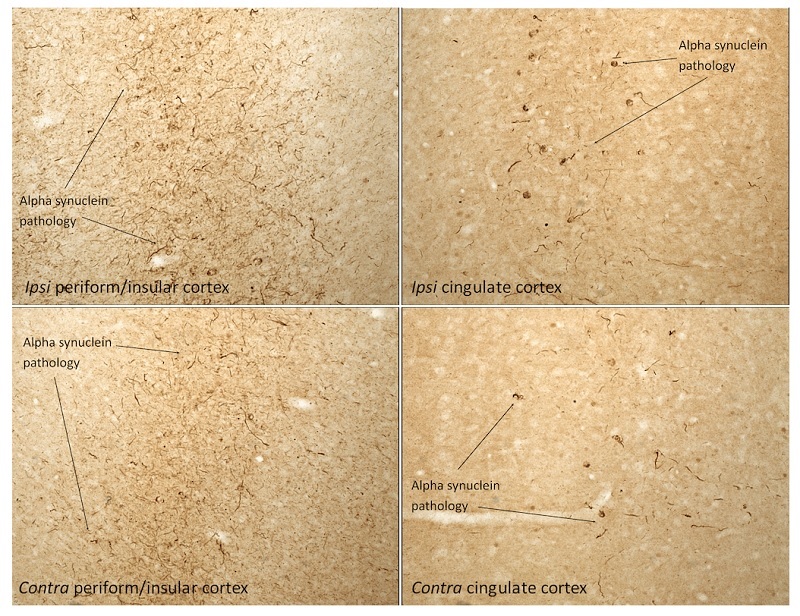
Type 1マウスα-シヌクレインPFF(#SPR-324)を注射したラット脳の免疫組織化学染色像
試料:メスのSprague-Dawleyラット。
下記2ヶ所に16μgのマウスType 1 α-シヌクレインPFF(#SPR-324)を注射した。
頭蓋骨からのAP + 1.6、ML + 2.4、DV-4.2
頭蓋骨からのAP-1.4、ML + 0.2、DV-2.8
注射後30日に生理食塩水灌流とそれに続く48時間の4%PFA固定
一次抗体: Rabbit Monoclonal Anti-pSer129 alpha Synuclein Antibody(#SPR-324)
二次抗体:Biotin-SP Donkey Anti-Rabbit IgG (H+L) Antibody
ABC法によりシグナル増幅、DAB染色を行った。倍率:20倍
α-シヌクレインの病変は、注射部位と同じ側(同側)と反対側(反対側)の両方のペリフォーム/島皮質と帯状皮質に見られた。
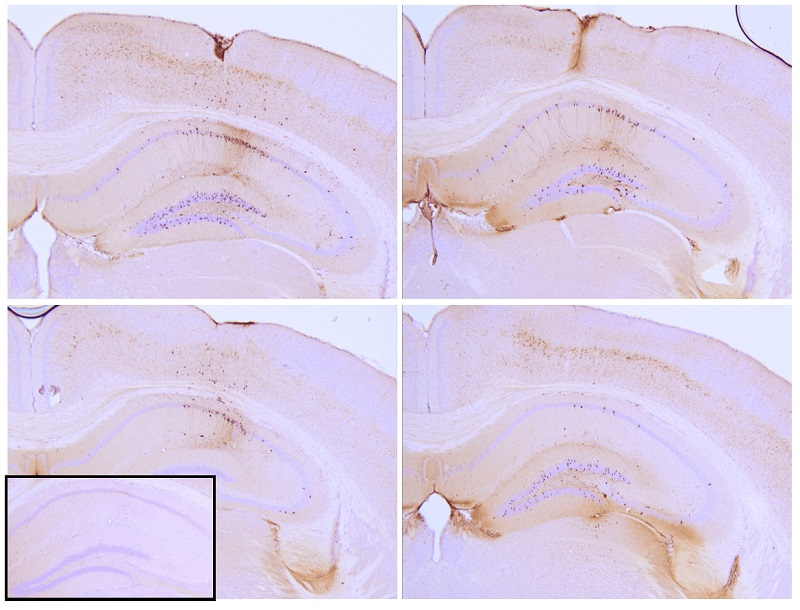
K18 P301LタウPFF(SPR-330)を注射したP301Lマウス海馬の蛍光免疫染色像
注射後9週間の注射部位でのタウ病変を示している。抗AT8(pSer202/pThr205)タウ抗体はもつれのような封入体を示した。
挿入図:ネガティブコントロール。実験はreMYNDNVで実施された。
追加しました。
神経変性疾患におけるαシヌクレインとタウの相互作用
著者:Patricia Thomson
α-シヌクレインとタウは、神経変性疾患に関係する重要なタンパク質です。レビー小体へのα-シヌクレインの凝集はパーキンソン病(PD)の病理学的特徴であり、神経原線維変化へのタウの凝集は、プラークへのアミロイド-ベータの凝集とともに、アルツハイマー病(AD)の特徴です。
「シヌクレイノパチー(synucleinopathies)」と「タウオパチー(tauopathies)」は機能を共有することが多く、αシヌクレインとタウは互いの凝集を促進する方法で相互作用する可能性があります。
カテゴリー名をクリックすると製品の詳細Web記事をご覧いただけます。
アルツハイマー病におけるαシヌクレイン
ADは通常、アミロイドベータプラークとタウ神経原線維変化を特徴としています。しかし、AD患者の脳の半分以上にはレビー小体1も含まれていることがわかり、AD患者の脳脊髄液(CSF)には高レベルのα-シヌクレインが含まれていました2。ADにおけるα-シヌクレイン及びレビー小体の役割は十分に理解されていません。レビー小体は健康な被験者の脳にも存在する可能性があり3、発症前または神経保護的である可能性があります4。ADはタンパク質の恒常性の破壊を伴うため、α-シヌクレインなどの凝集しやすいタンパク質の誤った折り畳みが疾患進行の下流効果である可能性があります5。
パーキンソン病のタウ
神経原線維変化は、散発性PD6およびパーキンソン病認知症(PDD)で発生する可能性があります7。
αシヌクレインとタウの共局在
もつれとレビー小体は偶然に共起するのではなく、タウとαシヌクレイン、およびアミロイドベータが互いの凝集を促進するためであるとの仮説が立てられています10,11。神経原線維変化とレビー小体が同じ病状で共存できるだけでなく、α-シヌクレインとタウもこれらの凝集体内に共局在する可能性があります8,9。
αシヌクレインとタウの相互作用
αシヌクレインはタウのオリゴマー化12とフィブリル化を促進することができます10。逆に、タウはαシヌクレインの凝集を誘発する可能性があります11,12。
これは、in vitroおよびマウスモデルで見ることができます。高度なADをモデル化するために使用されるトランスジェニックマウスでは、α-シヌクレイン導入遺伝子がないにもかかわらず、α-シヌクレイン封入体が見られました15。リン酸化タウの量の増加は、PDの神経毒誘発性16およびα-シヌクレイン過剰発現マウスモデルでも見られました17。
αシヌクレインによるタウ凝集の促進
αシヌクレインは、微小管を安定化させるタウの能力を低下させることにより、タウオパチーを引き起こすと考えられています18。
タウおよびα-シヌクレイン複合体を形成してタウのリン酸化につながると考えられるプロセスを、GSK3βが媒介している可能性があります18。αシヌクレインの負に荷電したC末端領域がタウの正帯電中央領域と静電的に相互作用し、タウと微小管との間の相互作用を破壊すると考えられています14。
タウによるαシヌクレインの凝集凝集の促進
興味深いことに、タウの過剰発現は、α-シヌクレイン凝集体の数を増加させますが、それらのサイズは減少させることが示されています13。小さいフィブリルはより毒性があると考えられているため、これはαシヌクレインの毒性の増強を説明している可能性があります。正に帯電したタウは、α-シヌクレインタンパク質間の反発相互作用を妨害し、凝集を促進すると考えられています14。
アミロイドβは、αシヌクレインとタウの両方と相互作用するため、これらのプロセスにも関与している可能性が高いことに注意する必要があります。
参考文献
- Hamilton, R.L., Brain Pathology, 10(3):378~384(2000).
- Slaets, S., et al., Alzheimer’s and Dementia, 10(5):S290~S298(2014).
- Jellinger, K.A., J. Neural. Transm. (Vienna), 111(10-11):1219~1235(2004).
- Wakabayashi, K., Rinsho Shinkeigaku, 48(11):981~983(2008).
- Kikis, E.A., et al., Adv. Exp. Med. Biol., 964:138~159(2010).
- Joachim, D.L., et al., Ann. Neurol., 22:514~520(1987).
- Irwin, D.J., et al., Nat. Rev. Neurosci., 14(9):626~636(2013).
- Ishizawa, T., et al., J. Neuropathol. Exp. Neurol., 62:389~397(2003).
- Fujishiro, H., et al., Acta. Neuropathol., 116(1):17~24(2008).
- Giasson, Bl., et al., Science, 300(5619):636~640(2003).
- Lee, V.M., et al., Trends Neurosci., 27(3):129~134(2004).
- Castillo-Carranza, D.L, et al., Biological Psychiatry, 84:466~508(2018).
- Badiola, N., et al., PLoS ONE, 6(10): e26609.
- Dasari, A.K.R., et al., Biochemistry, 58:2814~2821(2019).
- Chen, W., UC Irvine Electronic Theses and Dissertations
- Duka, T., et al., Faseb J., 20:2302~2312(2006).
- Haggerty, T., et al., Eur. J. Neurosci., 33(9):1598~1610(2011).
- Carnwath, T., et al., Neuropsychiatr. Dis. Treat., 14:1685~1695(2018).
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。


