HOME > 試薬 > 遺伝子工学 > トランスフェクション > トランスフェクション手法の紹介・比較
トランスフェクション手法の紹介・比較
掲載日情報:2022/07/27 現在Webページ番号:65100
陽イオン性脂質、ポリマー、マイクロインジェクション、マグネットフェクションなど、さまざまな遺伝子導入(トランスフェクション)方法の概略について、それぞれの特長をご紹介します。
※ 本製品は研究用です。研究用以外には使用できません。
追加しました。
-
2022/11/21
試薬 サンプル
- トランスフェクション試薬選択ガイドはこちら
- トランスフェクションとは
- 遺伝子導入の歴史
- 各遺伝子導入法の概要・比較
- 最適な導入手法を検討するために
- Reference(参考文献)
- トランスフェクションのプロトコル
- トラブルシューティング
トランスフェクション試薬選択ガイドはこちら
追加しました。
トランスフェクションとは
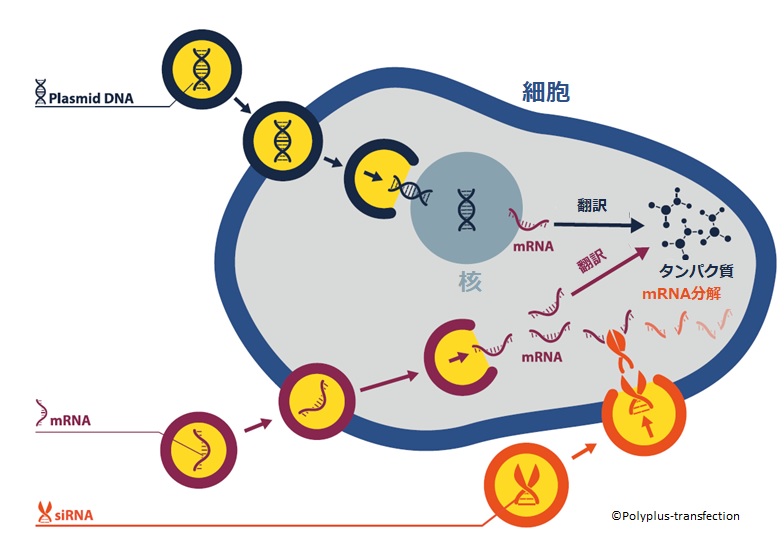
トランスフェクションとは、真核細胞に効率的に核酸を導入する手法で、非常に多くの研究室で、幅広く用いられています。この技術は、遺伝子発現調節やタンパク質機能解析、遺伝子治療の研究、組換えタンパク質の大量生産などに用いられ、近年の生命科学の研究において基本となる手法です。
トランスフェクション試薬の種類を大別すると、1960 年代に開発されたDEAE-デキストランを用いた方法(文献1、文献2)、1970 年~1980 年代に開発されたリン酸カルシウム法(文献3、文献4)、さらに、近年では陽イオン性リポソームを用いたリポフェクション法や陽イオン性ポリマーを用いた方法などがあり、数多くのトランスフェクション試薬が販売されています。
トランスフェクション法が一般的な実験手法となった今日では、細胞やアプリケーションの種類や導入する目的の生体分子の種類など、多様な条件に対応するために様々なトランスフェクション試薬が販売されており、トランスフェクション効率の高さ、タンパク質発現効率、毒性の低さ、細胞の機能や代謝への影響の低減などの点において、次々に優れた製品が開発、改良され、絶えず進化を続けています。
生化学的手法によるトランスフェクションの原理
追加しました。
遺伝子導入の歴史
生細胞へ効率的に核酸を導入する手法の開発は、古くから試みられてきました。1950年代頃、細胞はウイルスから抽出された核酸を取り込み、タンパク質を発現することが報告されてきました(文献5、文献6)。1965年に、Vaheriらによって、陽イオン性を持つDEAE-デキストランとDNAの混合物が細胞内に導入されることを見出しました(文献1)。それ以降、5年以上に渡って目立った報告はありませんでしたが、1973年にGrahamらによりDNAとリン酸カルシウムの共沈を利用した方法が報告され、遺伝子導入は、生物学分野において、日常的に実施されるようになりました(文献3)。この遺伝子組み換え技術の開発は、近代の遺伝子工学技術の新時代の幕開けとなりました。1980年代には、Felgnerらにより陽イオン性脂質を用いた高効率なトランスフェクション法が報告され、それ以降トランスフェクションに関わる報告が相次ぎます(文献7)。
現在では、陽イオン性脂質、デンドリマー、Polyethylenimine (ポリエチレンイミン、PEI)等のポリマーを利用した試薬による方法に加え、ウイルスによる遺伝子導入、エレクトロポレーション、マイクロインジェクション等による直接遺伝子を細胞に導入する方法が開発され、盛んに用いられています。
追加しました。
各遺伝子導入法の概要・比較
トランスフェクション技術の進展により、効率は次々に向上する一方、試薬や方法の選択肢が増え、複雑になりました。各実験に合わせて最適な方法を選択するには、様々な要因を慎重に検討する必要があります。
導入手法
①リン酸カルシウム
②DEAE-デキストラン
③陽イオン性脂質
④ポリマー
⑤ウイルス
⑥マグネットフェクション
⑦マイクロインジェクション
⑧エレクトロポレーション
⑨遺伝子銃(パーティクルガン)
| 手法 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
|---|---|---|---|---|---|---|---|---|---|
| 導入分子 | DNA、RNA | DNA、RNA | DNA、RNA、 タンパク質 |
DNA、RNA | DNA、RNA | DNA、RNA (ウイルスによる導入効率上昇も可能) |
DNA、RNA、 タンパク質 |
DNA、RNA | DNA、RNA |
| 導入対象例 | 導入が簡単な細胞株 | 導入が簡単な細胞株 | 細胞株・初代培養細胞 | 細胞株・初代培養細胞 | 導入困難な細胞株・初代培養細胞 | 導入困難な細胞株・初代培養細胞 | 導入困難な細胞株・初代培養細胞 | 導入困難な細胞株・初代培養細胞 | 導入困難な細胞株・初代培養細胞 |
| 浮遊細胞への対応 | × | × | 〇 | 〇 | 〇 | 〇 | × | 〇 | 〇 |
| in vivo導入* | × | × | 〇 | 〇 | 〇 | 〇 | 〇 | 〇 | 〇 |
| 導入効率の目安 | + | + | ++ | ++ | +++ | +++ | +++ | ++ | ++ |
| 毒性 | ++ | + | ++ | + | +++ | +++ | + | +++ | +++ |
| コスト | 低 | 低 | 低 | 低 | 中 | 低 | 高 | 高 | 高 |
| 実験完了に必要な期間 | 数日 | 数日 | 数日 | 数日 | 数週間以上 | 数日 | 数日 | 数日 | 数日 |
*in vivo導入に対応した製品の使用を推奨。
追加しました。
最適な導入手法を検討するために
- in vitro導入か、in vivo導入か
- 導入する細胞、組織の種類は何か
- 浮遊細胞か、接着細胞か
- 導入物質は何か
- 一過性発現か、安定発現か
- 導入効率
- 細胞毒性
- 知識と経験
- 導入に必要な時間
- コスト
- 低い導入効率を改善する選択肢:マグネットフェクション
- ターゲティングタンパク質, ペプチド
in vitro導入か、in vivo導入か
初めて行う実験で、遺伝子導入の方法を選択するにあたり、最初に導入する分子(核酸、タンパク質)の種類とターゲットとなる細胞の状況(in vitro、in vivo等)を決める必要があります。in vitroで培養された細胞とin vivoで標的となる細胞に導入を行う場合では、方法や考慮が必要な問題点に大きな違いがあります。例えばin vivoでの導入では、どのようにして標的以外の細胞を避けながら、目的の細胞にのみ導入するのかを検討する必要があります。
特定の細胞のみを標的として導入する方法としては、細胞表面のレセプターに作用するシグナルペプチドを用いる方法や、特定の細胞のみに感染するウイルスを用いる方法が、最初に挙げられます。別のアプローチとしては、ガン細胞や不死化細胞など分裂が盛んな細胞に効率的に導入できるレトロウイルスや陽イオン性脂質を用い、結果として選択的に標的となる細胞に遺伝子を導入する方法があります。
in vivoでの遺伝子導入を行う場合に考えなければならない重要な問題として、導入方法の免疫応答性の問題があります。特に、免疫原性の高いウイルスベクターを使用する場合、影響を考慮する必要があります。逆に、化学的導入法 (リポフェクションやポリマー等)はin vivo導入においても、強い免疫応答を示しません。
一般的に、ウイルスベクターを用いる場合は、化学的導入法より高度な安全対策が必要になります。
導入する細胞、組織の種類は何か
各細胞種に対する遺伝子導入の難易度は、様々な理由で異なります。従って、目的としている細胞の遺伝子導入を行っている文献を先に確認することが必要で、それにより正確な導入方法や実際の導入効率等の情報が得られる可能性があります。場合によっては、各論文の著者に直接不明点を確認したり、トランスフェクション試薬の製造、販売元に問い合わせたりすることで、各細胞に対する試薬の導入効率の情報等が得られる場合があります。
初代培養細胞など一部の細胞は、非常にトランスフェクションが困難とされています。これらの細胞に対する導入方法の選択には、事前に十分な調査を行う必要があります。
実績細胞株データベース
メーカー毎に、細胞株ごとの導入プロトコルや、各試薬での導入実績のある細胞株を検索できます。
 |
 |
|
|
■
Polyplus-transfection Database |
■ OZ-Biosciences Database |
浮遊細胞か、接着細胞か
一般に用いられている細胞株は接着細胞が多く、培養中は細胞培養プレートの表面や、培養器材、培養膜等の足場に接着した形で増殖します。一部、液体の培地に浮遊した形で培養が可能な細胞もありますが、接着細胞よりもトランスフェクションが困難とされています。そのため、浮遊細胞に対する導入には、細胞毒性が高いエレクトロポレーション、遺伝子銃、マイクロインジェクションやウイルス粒子等を用いて、導入後の実験が問題無く行えるだけの効率が得られるように条件を検討する必要があります。
一部の陽イオン性脂質ベースのトランスフェクション試薬では、浮遊細胞に対しても、高い導入効率が得られるとされており、コストが低く、使用も簡単なため、まず試してみることも選択肢の1つです。
導入物質は何か
遺伝子導入方法を決定するにあたり、導入する分子の種類(DNA、RNA…)を検討することも必要です。例えば、siRNAの導入用に開発されたトランスフェクション試薬は、プラスミドDNAの導入効率が低い場合があり、またプラスミドDNAの導入用に開発されたトランスフェクション試薬は、オリゴDNAの導入効率が低い場合があります。各試薬の製造、販売元の情報から、各分子に対する導入効率の情報を得ることができるほか、各種文献や、実際に使用している研究者から直接情報が得られる場合もあります。
一過性発現か、安定発現か
宿主細胞へ導入された遺伝子が発現する際、【導入遺伝子が宿主細胞の染色体とは別に存在して遺伝子を発現する場合】と、【染色体上に挿入される場合】に大別されます。
前者のケースは、一過性発現(Transient Expression)と呼ばれ、導入遺伝子の発現は、時間の経過と共に減衰し、数日程で消失します。これは、宿主細胞による導入遺伝子の分解や放出、細胞分裂による娘細胞への分配等が原因とされています。
一方後者のケースは、安定発現(Stable Expression)と呼ばれ、導入された遺伝子が染色体上に組み込まれているため、長期に渡って安定的に発現を継続します。どちらの発現期間が必要かどうかは、実験の内容により異なるため、実験計画に応じて遺伝子の導入方法を選択する必要があります。
ウイルスベクターを用いる場合、ウイルスの種類によって、一過性発現になるか安定発現になるかが異なります。一方、化学的または物理的な導入方法の場合、実施を検討している方法が、一過性発現と安定発現のどちらに適しているかを文献等で事前に確認し、場合によっては、試薬や機器の製造、販売元に確認する必要があります。
導入効率
多くの実験では可能な限り高い導入効率が求められます。特に存在量の少ない遺伝子導入産物の検出を行う場合、高い効率を得られるかどうかは、非常に重要なポイントです。特にin vivoの系において、ウイルスベクターによる遺伝子導入は、多くの場合、高い効率で導入することができます。
一方で、一般的によく用いられている細胞株(HEK293、COS細胞、CHO-K1等)にin vitroで遺伝子導入を行う場合には、陽イオン性脂質を用いた方が、ウイルスベクターを用いる場合より早く、安全に、高い導入効率が得られます。
細胞毒性
各トランスフェクション方法やトランスフェクション試薬が持つ細胞毒性も、導入効率に影響を与えます。多くの形質転換体を必要としない場合、細胞毒性は大きな問題にはなりませんが、ほとんどの実験では、受け入れられない問題となります。
エレクトロポレーション法や、遺伝子銃(パーティクルガン)は、一般に細胞毒性が非常に強く、大部分の細胞が死に至る事もあります。また、DEAE-デキストラン法において、DMSOやグリセロールを用いた場合、特に細胞毒性が高くなると言われています。
現在市販されている陽イオン性脂質やポリマーベースのトランスフェクション試薬は、各細胞に対する細胞毒性の度合いが異なるため、トランスフェクション時の使用濃度等の条件検討により、細胞毒性が低くなる最適な条件を探す必要があります。ほとんどの場合、各試薬のマニュアルには、条件検討用のプロトコールの例が紹介されています。また、繰り返しになりますが、事前に文献等により、条件の調査を行うことで、細胞毒性についての情報を得ることができます。
知識と経験
各トランスフェクション法のプロトコールは様々で、必要とされる技術や試薬が異なるため、実施する研究者の知識と経験も影響を与えます。ウイルス粒子を用いる方法は、化学的または物理的導入法より複雑な操作が必要で、高い効率を得るには熟練の技術や経験が必要になります。一方リン酸カルシウム法などの化学的方法では、実験条件の僅かな変化が結果に影響を与えます。一般に陽イオン性脂質やポリマーを用いたトランスフェクション試薬を用いた場合、既にプロトコールの改良が重ねられ、確立されている場合が多く、比較的簡単に実験を進めることができ、結果のばらつきも少なくなっています。
導入に必要な時間
遺伝子導入の実験の実施に必要な時間も、各方法で異なります。ウイルス粒子を用いた方法では、非常に高い導入効率が得られる一方、結果を得るまでに2週間から場合によっては1ヶ月以上の時間が必要になることがあります。それに対して、化学的/物理的導入法では、ウイルス法より導入効率が低くなることが多いですが、数日で結果を得ることができます。導入効率や、操作に必要な時間等を考慮して、最適な導入方法を選択する必要があります。
コスト
遺伝子導入の方法を決定する場合、各種導入方法に必要なコストについても、検討する必要があります。エレクトロポレーションや遺伝子銃等を用いた物理的方法は、実施に必要な機器の購入が必要な上、追加の付属品や消耗品、試薬のランニングコストについても考慮する必要があり、最もコストがかかります。ウイルスベクターを用いた遺伝子導入の場合、各種試薬に加えて、ウイルス調製の期間が長く、適切な方法でウイルスを廃棄する必要があり、この方法も一定のコストがかかります。陽イオン性脂質やポリマーを用いた方法では、特別に必要な機器が無く、ウイルス調製など準備の時間も必要が無いため、比較的コストが抑えられます。この場合、試薬の費用と実施するトランスフェクションの回数や量に応じてコストが変わってきます。最も低コストな方法として、リン酸カルシウム法や、Naked DNA法がありますが、高い導入効率を得ることは困難です。
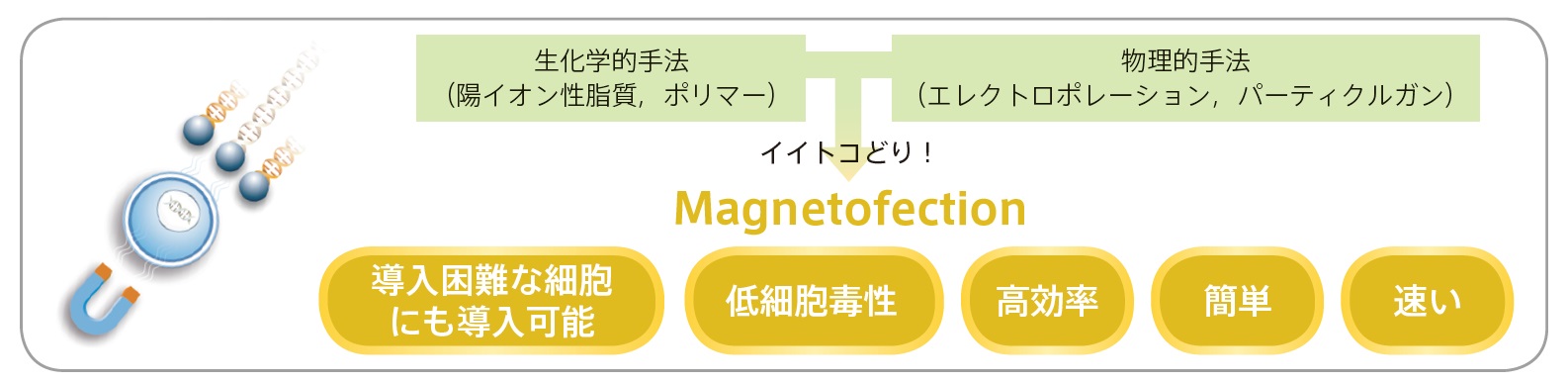
低い導入効率を改善する選択肢:マグネットフェクション
マグネットフェクション(マグネトフェクション、Magnetofection)とは、特別な陽イオン性の磁性ナノ粒子に、核酸とトランスフェクション試薬の複合体、またはウイルスを結合させて、強力な磁石を用いて細胞に高効率に導入または感染させる方法です(文献8)。磁性ナノ粒子との複合体を強力な磁力によって短時間に細胞の表面に濃縮し、高い導入効率または感染効率を得ることができます。
マグネットフェクションに用いられる磁性ナノ粒子は完全な生分解性で、その表面は導入対象、目的によって異なる陽イオン性分子の修飾が行われています。各導入対象となる分子(DNA、RNA、ウイルス等)と磁性ナノ粒子は、塩誘導性のコロイダル凝集と静電気的相互作用により結合しており、磁性プレートによる磁力によって、細胞表面に濃縮されます。そして、核酸の場合はエンドサイトーシスによって細胞内に取り込まれ、ウイルスの場合は、濃縮作用により高効率に細胞に感染します。物理的導入で細胞表面にダメージを与える遺伝子銃や、電気的なショックを与えるエレクトロポレーションとは異なり、マグネットフェクションでは、非常にマイルドな条件下で操作を完了することができます。
核酸をマグネットフェクションで導入した場合、磁気プレートによる操作完了から10~15分程度で細胞内に取り込まれます。24~72時間で、ほとんどの磁性ナノ粒子は細胞質や液胞、そして一部核内に局在しますが、この磁性ナノ粒子は細胞の機能に影響を与えません。
磁気プレートを別途用意する必要がありますが、現在使用中のトランスフェクション試薬と組み合わせて使用できる製品(CombiMag、OZ Biosciences社)も販売されており、低い導入効率を改善する選択肢の1つと言えます。
マグネットフェクションシリーズ
詳細はこちらをご覧下さい。
磁気粒子を用いてトランスフェクション効率を向上させる試薬
CombiMag
他のトランスフェクション試薬(脂質系やカチオン性ポリマー系)との併用により、導入効率を向上させることができます。
磁気による濃縮を行うため、従来のトランスフェクション試薬やエレクトロポレーションに比べ、非常に高いトランスフェクション効率を実現することができます。
※ 本製品のみでトランスフェクションはできません。
ターゲティングタンパク質, ペプチド
タンパク質やペプチドと陽イオン性脂質を組み合わせて、核酸を目的となる細胞へ輸送したり、効率的に細胞内へ核酸を取り込ませたりすることも広く行われています。
- 例えば、インテグリンの標的ペプチドは、様々な細胞に対するDNAと陽イオン性脂質複合体のトランスフェクション効率を大幅に向上させることが報告されています(文献9)。
- また、トランスフェリンペプチドを含む脂質とDNAの複合体は、ペプチドを含まない複合体と比較して、初代培養細胞へのトランスフェクション効率を向上させることも報告されています(文献10)。
- DNAとポリカチオンペプチドであるプロタミン硫酸塩, 陽イオン性脂質の錯体は、脂質のみを用いたトランスフェクションと比較して、培養細胞での遺伝子の発現が向上していることが報告されています(文献11)。
- 融合ペプチドであるGALAやインフルエンザウイルスのヘマグルチニンを構成するHA サブユニットのN末端側のペプチドも、陽イオン性脂質と同時に使用することで、トランスフェクション効率を向上させることが報告されています(文献12、文献13)。
- SV40 T抗原やアフリカツメガエルのヌクレオプラスミン、hnRNP A1タンパク質のM9配列、ヒト免疫不全ウイルス(HIV)のRevとTatタンパク質等に見られる、核移行シグナルペプチドも、導入されたDNAの核移行の促進により、トランスフェクション効率を高めることが報告されています(文献14、文献15)。
これらの標的タンパク質やペプチドを用いることで、トランスフェクションと標的への核酸の輸送効率を向上するケースがあります。特にトランスフェクションが困難な細胞への導入や、in vivoでの遺伝子導入技術の開発に用いられています。一方で、in vivoではタンパク質やペプチドは強い抗原性を示すことがある点や、通常用いられているトランスフェクション試薬を使用した場合より高コストであることが、欠点として挙げられます。
追加しました。
Reference(参考文献)
- Vaheri A、Pagano JS. 1965. Infectious poliovirus RNA: a sensitive method of assay. Virology. 27(3):434-436.
- McCutchan JH、Pagano JS. 1968. Enchancement of the infectivity of simian virus 40 deoxyribonucleic acid with diethylaminoethyl-dextran. J. Natl. Cancer Inst. 41(2):351-357.
- Graham FL、van der Eb AJ. 1973. A new technique for the assay of infectivity of human adenovirus 5 DNA. Virology. 52(2):456-467.
- Chen C、Okayama H. 1987. High-efficiency transformation of mammalian cells by plasmid DNA. Mol. Cell Biol. 7(8):2745-2752.
- Alexander HE、Koch G、Mountain IM、van Damme O. 1958. Infectivity of ribonucleic acid from poliovirus in human cell monolayers. J. Exp. Med. 108(4): 493-506.
- Holland、JJ、McLaren、LC、Syverton、JT. 1959. Mammalian cell-virus relationship. III. Poliovirus production by non-primate cells exposed to poliovirus ribonucleic acid. Proc. Soci. Exp. Biol. Med. 100(4): 843-845.
- Felgner PL、Gadek TR、Holm M、Roman R、Chan HW、Wenz M、Northrop JP、Ringold GM、Danielsen M. 1987. Lipofection: a highly efficient、lipid-mediated DNA-transfection procedure. Proc. Natl. Acad. Sci. U.S.A. 84 (21): 7413-7417.
- Scherer F、Anton M、Schillinger U、Henke J、Bergemann C、Kruger A、Gansbacher B、Plank C. 2002. Magnetofection: enhancing and targeting gene delivery by magnetic force in vitro and in vivo. Gene Ther. Jan. 9(2):102-109.
- Hart SL, Arancibia-Carcamo CV, Wolfert MA, Mailhos C, O'Reilly NJ, Ali RR, Coutelle C, George AJ, Harbottle RP, Knight AM, Larkin DF, Levinsky RJ, Seymour LW, Thrasher AJ, Kinnon C. 1998. Lipid-mediated enhancement of transfection by a nonviral integrin-targeting vector. Hum. Gene Ther. 9(4):575-585.
- Duzgune? N, De Ilarduya CT, Simoes S, Zhdanov RI, Konopka K, Pedroso de Lima MC. 2003. Cationic liposomes for gene delivery: novel cationic lipids and enhancement by proteins and peptides. Curr. Med. Chem. 10(14):1213-1220.
- Sorgi FL, Bhattacharya S, Huang L. 1997. Protamine sulfate enhances lipid-mediated gene transfer. Gene Ther. 4(9):961-968.
- Parente RA, Nir S, Szoka FC Jr. 1988. pH-dependent fusion of phosphatidylcholine small vesicles. Induction by a synthetic amphipathic peptide. J. Biol. Chem. 263(10):4724-4730.
- Kamata H, Yagisawa H, Takahashi S, Hirata H. 1994. Amphiphilic peptides enhance the efficiency of liposome-mediated DNA transfection. Nucleic Acids Res. 22(3): 536?537.
- Munkonge FM, Dean DA, Hillery E, Griesenbach U, Alton EW. 2003. Emerging significance of plasmid DNA nuclear import in gene therapy. Adv. Drug Deliv. Rev. 55(6):749-760.
- Ma H, Zhu J, Maronski M, Kotzbauer PT, Lee VM, Dichter MA, Diamond SL. 2002. Non-classical nuclear localization signal peptides for high efficiency lipofection of primary neurons and neuronal cell lines. Neuroscience. 112(1):1-5.
追加しました。
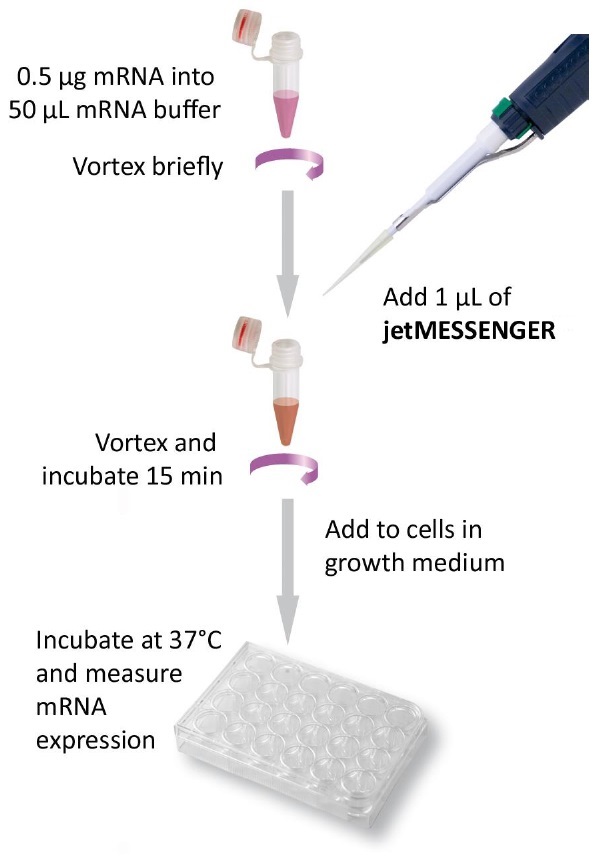
トランスフェクションのプロトコル
mRNA導入用試薬 jetMESSENGERの例
追加しました。
トラブルシューティング
Q. トランスフェクション効率が低い。
- ウェルに加えるトランスフェクション試薬と導入物質の量を増やし、最適化して下さい。
- 核酸を試薬付属のバッファーで希釈したかどうか、再確認して下さい。
- ルシフェラーゼやGFPなどのレポーター遺伝子の導入を、ポジティブコントロールとして試してみて下さい。
- 導入物質の品質(純度が高く夾雑物がないなど)を確認して下さい。siRNAやmRNAの導入では、RNaseフリーの環境であることも重要なポイントです。
Q. 細胞毒性が高い。
- 使用する試薬の量を減らしてみて下さい。
- ウェルあたりに添加する導入物質の量を減らしてみて下さい。
- より早い時点(例えば、48時間後ではなく24時間後)でトランスフェクション結果を確認して下さい。
トランスフェクション実験のためのTIPS
トランスフェクション実験のコツが紹介されています。
 |
 |
|
|
■
Polyplus-transfection ブログ |
■ OZ-Biosciences FAQ |
トランスフェクション試薬選択ガイド
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。