電気泳動(SDS-PAGE) - ウエスタンブロット(Western Blot)特集
掲載日情報:2020/11/04 現在Webページ番号:33381
タンパク質の電気泳動(SDS-PAGE)ゲル、サンプルバッファー、タンパク質分子量マーカー、電気泳動槽などをご紹介します。
※ 本製品は研究用です。研究用以外には使用できません。
追加しました。
-
2025/11/04
試薬 特別価格
[VIP]ウエスタンブロッティング用試薬など30%OFFキャンペーン[~2026/02/27]
期間:2025/11/04 ~2026/02/27
Energenesis Biomedical Co., Ltd.(旧 Visual Protein Biotechnology Corp.)(VIP)
ウエスタンブロット(Western Blot)実験ナビゲーション
アイコンをクリックすると、各ウエスタンブロット(Western Blot)製品紹介ページへリンクします。
| 試料調製 | 電気泳動 | 転写 | ブロッキング/抗体反応 | 検出 | 受託サービス |
|---|---|---|---|---|---|
SDS-PAGE |
追加しました。
電気泳動(SDS-PAGE)の原理
|
ポリアクリルアミドゲル電気泳動(Polyacrylamide Gel Electrophoresis:PAGE)は、タンパク質や核酸といった生物高分子を分離するために最も広く使用されている実験手法の一つです。 高分子は分子の長さ、構造、電荷により電気泳動移動度が異なります。一般的に高分子を電気泳動する際はネイティブか変性状態で行いますが、分子の長さで分離する場合は変性状態(還元SDS-PAGE)で泳動します。一方で、タンパク質の3次元的構造などの情報を得る目的の場合は、Native-PAGEまたは非還元SDS-PAGE(還元剤を用いない)が行われます。 タンパク質の場合は、2-ME(メルカプトエタノール)やDTT(ジチオスレイトール)などの還元剤と陰イオン界面活性剤SDS(Sodium Dodecyl Sulfate:ラウリル硫酸ナトリウム)が変性に使用されます。還元剤によりジスルフィド結合が切断された線形ポリペプチド鎖にSDSが結合し、負に荷電します。 SDSが結合したポリペプチド鎖は、鎖長に応じた負電荷を有するため、ポリアクリルアミドゲルを用いて電気泳動を行うと、ゲルの網目状構造がふるいの役割を果たし、陽極へ向かう移動速度が異なります。大きい分子は遅く、小さな分子は速く移動するため、およその分子量に基づいて分離することができます。 こうした分離方法をSDS-PAGEと呼びます。ウエスタンブロッティングはSDS-PAGEと抗体による検出を組み合わせた手法で、様々な成分を含む生物試料などから特定のタンパク質を検出するために広く使用されます。 |
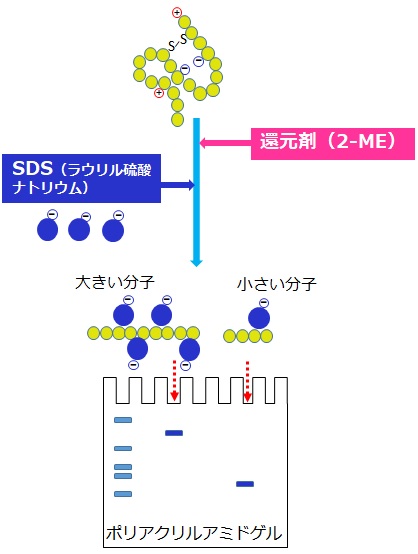 |
追加しました。
電気泳動(SDS-PAGE)プロトコル
- 分離するタンパク質の分子量に応じて使用するポリアクリルアミドゲルの濃度を決める。
・例1:100~500 kDaのタンパク質の場合 4~8%濃度のゲル
・例2:10~200 kDaのタンパク質の場合 4~20%濃度のゲル - ゲルを電気泳動装置にセットする。
- SDS-PAGE泳動バッファー(ランニングバッファー)を調製する。10×SDS-PAGE Running Buffer(RCK社:#MB-017)を使用する場合、10×バッファー 50 mlに脱イオン水450 mlを加えると1×バッファーが500 ml作製できる。
- 電気泳動装置のチャンバーに泳動バッファーを入れる。
- 試料の調製
・ライセート(サンプルバッファーで調製済み)の場合:
マイクロチューブに試料を適量移し、β-メルカプトエタノール(BME、2ME)を終濃度が0.55 Mになるように加える(例:ライセート試料 25 μlに対し、BME 1 μlを加える)。ピペッティングでよく混合する。
・その他のタンパク質試料の場合:
マイクロチューブに試料と、同量の2×サンプルバッファー(RCK社:Sample Buffer #MB-018)、0.55 M BMEを加える。試料のタンパク質濃度が充分高いことを確認しておく。タンパク質の種類や検出方法にもよるが、タンパク質終濃度で1~500 μgが必要。
・分子量マーカーの準備:
SDS-PAGEでは、未染色の分子量マーカーまたは染色済みのプレステイン分子量マーカーが使用される。PAGE後にウエスタンブロッティングを行う場合は、 プレステイン分子量マーカーの使用を勧める。
※還元剤としてDTT(ジチオスレイトール)を使用する場合や、サンプルバッファーにあらかじめ還元剤が含まれる場合もあります。 - 試料を入れたマイクロチューブを95℃のヒートブロックまたはウォーターバスに入れ、5分間加熱する。
- 加熱後、3分間遠心分離を行い、試料中の破片を沈殿させる。
- 試料をゲルにアプライする。ゲルの左側のレーンから順に分子量マーカーおよび試料をアプライする。ゲルによるが、1レーン当たり5~35 μlの試料をアプライする。タンパク質濃度が100~500 μg/mlの場合、1レーン当たり0.5~17.5 μgとなるようにする。
※注意:通常SDS-PAGE後のCBB(Coomassie Brilliant Blue)染色での検出限界は、精製タンパク質の場合 1 μg、ライセート試料の場合 10 μgとされている。 - 電気泳動装置の蓋を閉め、電極をパワーサプライに繋ぎ、定電圧 150 Vにセットして電源スイッチをONにする。
※注意:電源がONの間は電気泳動装置に触れない。タンクからバッファーが漏れてしまった場合も、必ず電源を切ってから対応する。 - 45~90分間電気泳動を行ったら、電源を切る。泳動装置やゲルの大きさによって泳動時間は異なる。サンプルバッファーに含まれる青色色素(BPB)のラインがゲルの下端まで進んだら直ちに電源を切って泳動を終了する。
- 電極を外し、泳動装置の蓋を開けてゲルホルダーを取り外す。ゲルプレートから慎重にゲルを外し、CBB染色など検出工程に進む。
追加しました。
電気泳動(SDS-PAGE)製品ラインナップ
サンプルバッファー
SDS-PAGE試料調製用のバッファーです。2-MEやDTTなどの還元剤は別途ご用意下さい。
| メーカー略称 | 製品説明 | 製品名 |
|---|---|---|
| RCK | SDS-PAGE用サンプルバッファー | SDS-PAGE Sample Buffer |
泳動バッファー
おススメ製品:AllView PAGE Buffer®(20×)
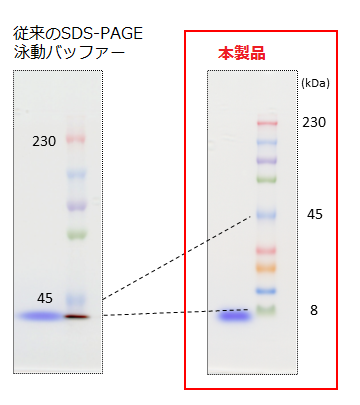

タンパク質SDS-PAGE用の泳動バッファーです。普段ご使用されている泳動バッファーを本製品に変えるだけで、自作ゲルでもグラジエントゲルのように広範囲な分子量のタンパク質の分離(分画)が可能となります。 |
泳動条件
分離ゲル濃度:6%、電圧(一定):250 V、
泳動試料:DynaMarker® Protein MultiColor StableⅡ(#DM660)
泳動バッファー:従来の泳動バッファー(25 mM Tris・HCl, 192 mM Glycine, 0.1% SDS)、AllView PAGE Buffer®(#DS520)
| メーカー略称 | 製品説明 | 製品名 |
|---|---|---|
| BDL | ワイドレンジでの分離が可能なSDS-PAGE用泳動バッファー | AllView PAGE Buffer®(20×) |
| RCK | SDS-PAGE用泳動バッファー | SDS-PAGE Running Gel Buffer |
プレキャストゲル
おススメ製品:フナ・楽・ゲル
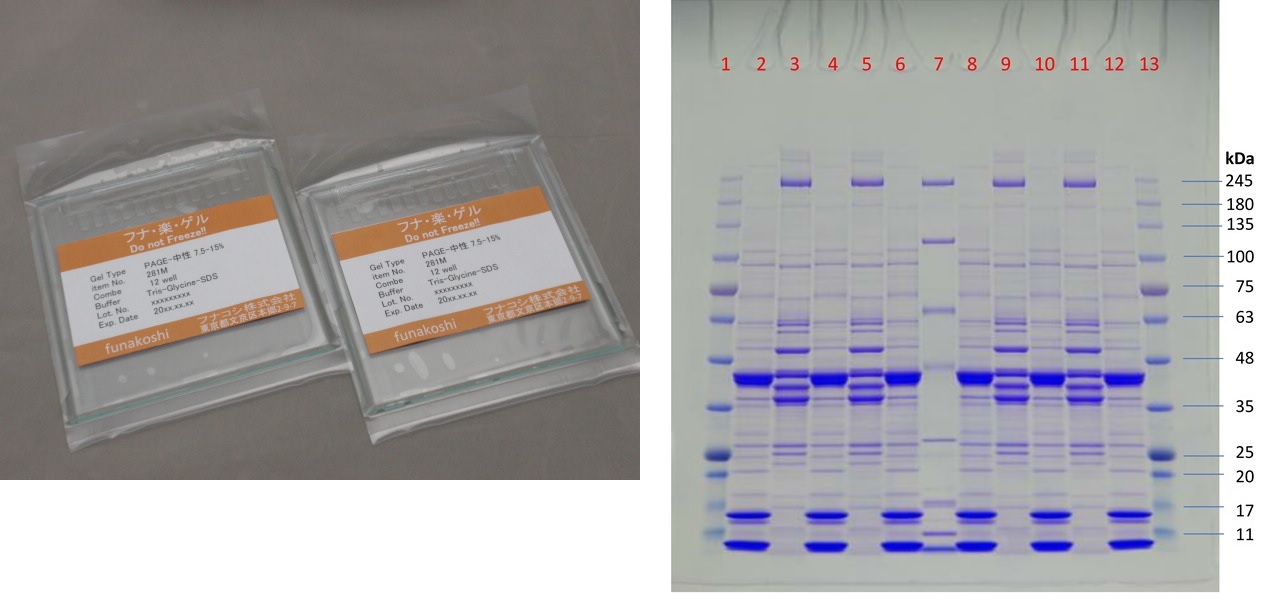
SDS-PAGE用、ガラスカセット仕様のプレキャストゲルです。ロット間差がなく安定した結果が得られます。
| メーカー略称 | 製品説明 | 製品名 |
|---|---|---|
| FAJ | 便利なプレキャストゲル | フナ・楽・ゲル |
| FTC | タンパク質分析用垂直型電気泳動用プレキャストゲル | Q-PAGE mini |
| GSC | SDSを含まない電気泳動用プレキャストゲル | ExpressPlus PAGE Gel |
| GSC | 試料アプライ量がアップ!電気泳動用プレキャストゲル | SurePAGE Gel |
分子量マーカー
おススメ製品:DynaMarker® Protein MultiColor Ladder Marker, StableⅡ

4℃の冷蔵庫で1年間保存可能な、着色済みタンパク質分子量ラダーマーカーです。凍結保存・融解不要で使用したい時にすぐ使えます。
| メーカー略称 | 製品説明 | 製品名 |
|---|---|---|
| BDL | タンパク質分子量ラダーマーカーラインナップ | BioDynamics Labolatory社 タンパク質分子量ラダーマーカー選択ガイド |
| BDL | 赤・青二色で着色されたプレステインタンパク質分子量ラダーマーカー | DynaMarker® Protein BlueRed Ladder Marker® |
| BDL | 4℃で長期保存可能で、そのまま使えるプレステインタンパク質分子量ラダーマーカー | Protein MultiColor Ladder Marker, Stable II, DynaMarker |
| BDL | スタンダードなタンパク質分子量ラダーマーカー | DynaMarker Protein Eco Ladder Marker |
ポジティブコントロール
12種類のエピトープタグを融合した組換え体タンパク質を含むE. coliライセートです。SDS-PAGEの際に試料とは別のレーンにアプライして一緒に泳動します。エピトープタグ抗体を用いたウエスタンブロッティングでポジティブコントロールとして使用できます。
| メーカー略称 | 製品説明 | 製品名 |
|---|---|---|
| RCK | ウエスタンブロット用ポジティブコントロール | 12-Epitope Tag Protein Marker Lysate |
ゲル染色用試薬
おススメ製品:QuickBlue Staining Solution
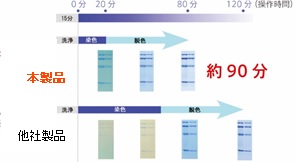 |
・90分でCBB染色が可能! ・検出限界は 8 ng (BSA) と高感度! ・脱イオン水のみで脱色可能! |
| メーカー略称 | 製品説明 | 製品名 |
|---|---|---|
| BDL | ポリアクリルアミドゲル中タンパク質のCBB染色試薬 | QuickBlue Staining Solution |
| VIP | ポリアクリルアミドゲルのネガティブ染色キット | VisPRO 5 minutes Protein Stain Kit |
電気泳動装置
おススメ製品:泳動くん

プレキャストゲル専用の電気泳動槽です。
| メーカー略称 | 製品説明 | 製品名 |
|---|---|---|
| FAJ | フナ・楽・ゲル専用 垂直式電気泳動槽 | 泳動くん |
パワーサプライ

SDS-PAGEに最適な電気泳動用電源です。
| メーカー略称 | 製品説明 | 製品名 |
|---|---|---|
| LNT | 電気泳動用パワーサプライ | ENDURO Electrophoresis Power Supply |
追加しました。
おすすめ製品記事
-
BioDynamics Laboratory Inc.(株式会社バイオダイナミクス研究所)
/ 高効率かつ低バックグラウンドなTAクローニングキット
FEWBlue TA Cloning Kit -
BIOSAN LTD.
/ コンパクトなマイクロプレートリーダー
HiPo MPP-96, Microplate Photometer -
ウエスタンブロット(Western Blot)特集 -
MP Biomedicals
/ コンピテントセル培養用SOB培地/SOC培地
Bacteria Medium SOB Medium, SOC Medium
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。

