HOME
>
試薬
>
抗体
>
一次抗体
>
技術情報:抗体のFcドメインのタンパク質工学的改変
HOME
>
試薬
>
創薬研究
>
医薬品製造・研究
>
技術情報:抗体のFcドメインのタンパク質工学的改変
技術情報:抗体のFcドメインのタンパク質工学的改変
掲載日情報:2021/02/17 現在Webページ番号:69746
抗体のFcドメインは単なる構造的骨格として扱われることも多いですが、重要な機能を有しており、主に以下の3つの観点からタンパク質工学的改変のターゲットになっています。
※Absolute Antibody社のヒト型組換え抗体(リコンビナント抗体)の改変・作製受託サービスはこちらをご覧下さい。
※本製品は研究用です。研究用以外には使用できません。
追加しました。
Fcドメインのタンパク質工学的改変と目的
1.Fcドメイン改変によるエフェクター機能の強化
抗体医薬品が標的としている最も重要な治療分野の1つががんであり、200を超える抗体が臨床試験を通過しています1。これらの抗体の主要な作用機序は、Fcドメインと補体成分C1qまたはFcγレセプターの相互作用による免疫系のリクルートを介した腫瘍細胞特異的な細胞障害です。しかし、多くの抗体は、有効性が不十分なために臨床試験で脱落しています2。そこで、抗体のエフェクター機能を高め、抗体依存性細胞傷害(ADCC*1)や抗体依存性細胞媒介性食作用(ADCP*2)などの細胞傷害活性を高める努力が行われています。
特に、Fcドメインとの親和性が低いレセプターFcγⅢaに対して、Fcドメインの親和性を高める研究が行われ、Fcドメイン - Fcレセプター間の結合を直接的または間接的に増強し、細胞傷害を有意に増強するFcドメイン内の多くの変異が同定されました2-5。Genentech社では変異S239D/A330L/I332E(3M: triple mutation)2,3、MedImmune社では変異F243L4、およびXencor社では変異G236A5が特定されました。
別のアプローチでは、Fcドメインの糖鎖付加に焦点を合わせています。FcγRはCH2ドメインの糖鎖と相互作用しますが、そこにある糖鎖の構造が抗体のエフェクター活性に影響を与えることが知られています6。最も代表的ものは、アフコシル化(非フコシル化)抗体であり、FcγRⅢaとの結合が増強されることでADCC活性が大幅に向上します7-10。
*1 ADCC:antibody dependent cell mediated cytotoxicity
*2 ADCP:antibody dependent cell mediated phagocytosis
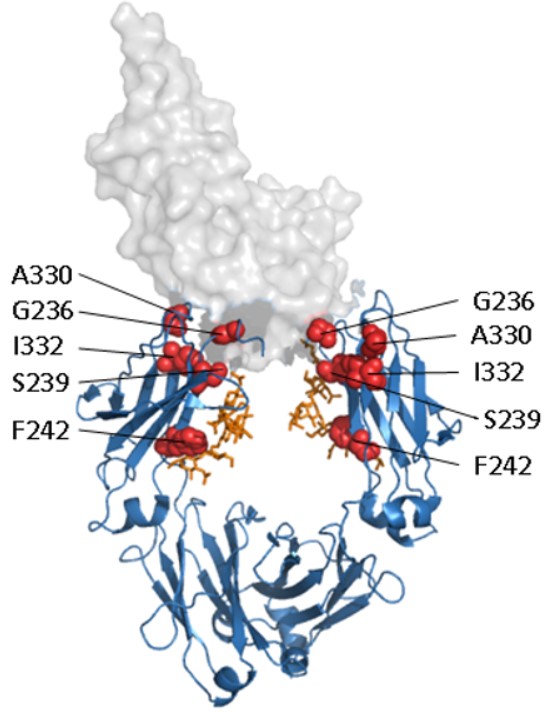
図1. FcγRⅢと複合体を形成したヒトIgG1 Fcドメインとエフェクター機能強化のターゲット
青色(リボンモデル):Fcドメイン
オレンジ色:糖鎖
赤色:エフェクター機能強化のターゲットとなるアミノ酸
灰色(空間充填モデル):FcγRⅢ(PDB 1T83)
2.Fcドメイン改変によるエフェクター機能の無効化
治療用抗体ではADCCおよび補体依存性細胞障害(CDC*3)の活性化が望ましいことが多いですが、目的によってはエフェクター機能を活性化できない抗体が求められることもあります。これにはIgG4が一般的に使用されてきましたが、IgG4はin vivoでFab-arm exchange(IgG4抗体間での重鎖の置換)が起こることから、近年好まれなくなりました11,12。
Fc改変により、FcドメインとFcγレセプターおよびC1qとの結合部位を決定し、ここに変異を加えることで結合を減弱または無効化します。
DuncanとWinterはアラニンスキャンニング法を使用し、Fcドメインのヒンジ部とCH2上部にまたがる領域にあるC1qの結合部位を初めて同定しました13,14。Genmab社は、FcγRとC1qの結合をほぼ完全に無効にできる組み合わせとして、変異体K322A、L234A、およびL235Aを同定しました15。同様の方法で、MedImmune社は後に、非常に類似した効果を持つ3つの突然変異のセットL234F/L235E/P331S(3M: triple mutation)を同定しました16。
また、FcRとの結合に必要なFcドメインのアスパラギン297の糖鎖を改変する方法もあります。アスパラギン297への点突然変異導入3,17、酵素的に脱グリコシル化されたFcドメイン18、グリコシル化阻害剤の存在下で発現されたリコンビナント抗体19、そして細菌で発現したFcドメイン20,21などではFcRとの結合能が失われることが確認されています。Absolute Antibody社は、Fcドメインに点突然変異を導入したFc Silent抗体を開発しました。これはFcレセプターとの結合や、抗体依存性細胞傷害(ADCC)でのエフェクター機能が無効化された、研究用およびアッセイ開発用の抗体です。
*3 CDC:complement dependent cytotoxicity
※Absolute Antibody社のFcドメインのエフェクター機能を抑制したリコンビナント抗体はこちらをご覧下さい。
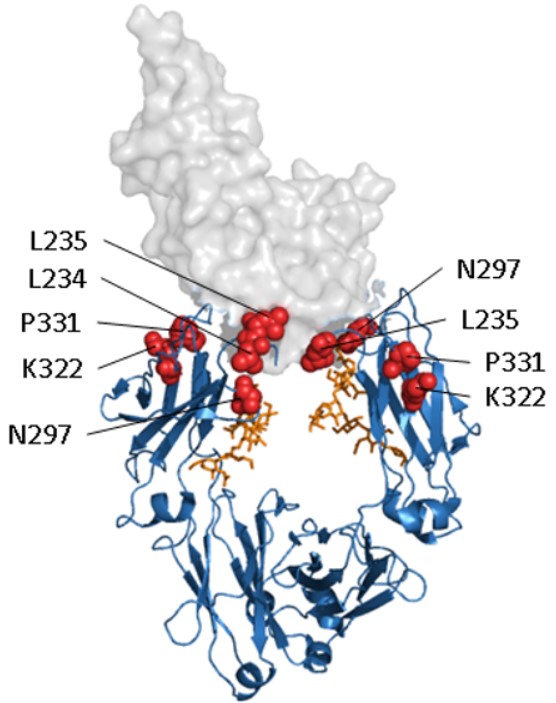
図2. FcγRⅢと複合体を形成したヒトIgG1Fcドメインとエフェクター機能無効化のターゲット
青色(リボンモデル):Fcドメイン
オレンジ色:糖鎖
赤色:エフェクター機能無効化のターゲットとなるアミノ酸
灰色(空間充填モデル):FcγRⅢ(PDB 1T83)
3.Fcドメイン改変によるIgGの血清半減期の延長
血清中のIgGは、FcRn(胎児性Fcレセプター)を介したリサイクルにより、通常の半減期は約21日と、長期間存在しています。しかし、さらに血中半減期を延長するために、FcドメインとFcRnの結合が、pH7.4では最小限に抑えられ、pH6.0で高まるような改変が多く試みられてきました。PDL BioPharma社では変異T250Q/M428Lを同定し、アカゲザルでのIgG半減期が約2倍に延長し22、MedImmune社は変異M252Y/S254T/T256E(YTE改変)を同定し、その結果、カニクイザルでのIgG半減期を約4倍に延長しました23,24。これらはまだヒトでは実証示されていませんが、半減期の有意な延長は、抗体医薬の有効性を維持または改善しながら、投与頻度を減少させる可能性があると期待されています。
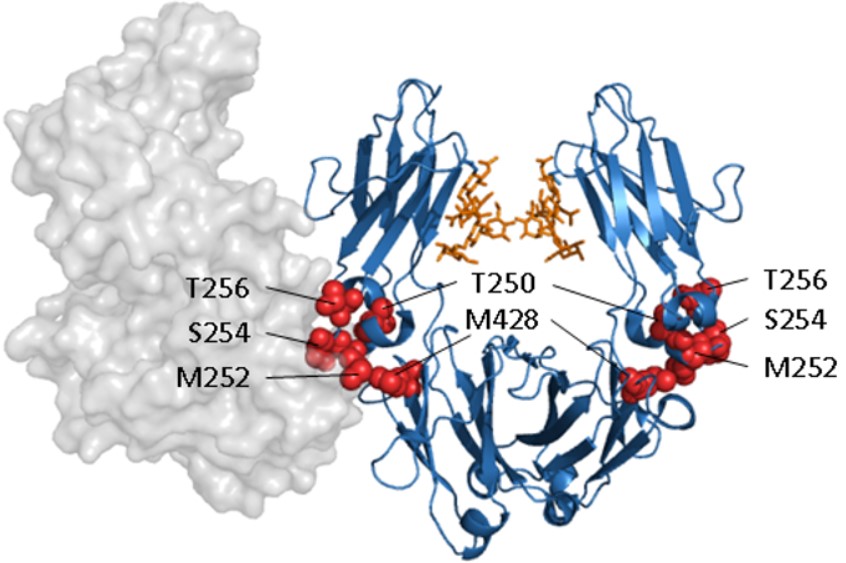
図3. FcRnと複合体を形成したヒトIgG1Fcドメインと、FcRnとのpH依存性相互作用増強のターゲット
青色(リボンモデル):Fcドメイン
オレンジ色:糖鎖
赤色:FcRnとのpH依存性相互作用の増強のターゲットとなるアミノ酸
灰色(空間充填モデル):FcRn-B2Mヘテロダイマー
参考文献:
- Reichert, J.M. and Valge-Archer, V.E., Nat. Rev. Drug. Discov., 6(5), 349(2007). PMID:17431406
- Lazar, G.A., et al., Proc. Natl. Acad. Sci. USA., 103(11), 4005(2006). PMID:16537476
- Shields, R.L., et al., J. Biol. Chem., 276(9), 6591(2001). PMID:11096108
- Stewart, R., et al., Protein Eng. Des. Sel., 24(9), 671(2011). PMID:21596686
- Richards, J.O., et al., Mol. Cancer Ther., 7(8), 2517(2008). PMID:18723496
- Jefferis, R., Methods Mol. Biol., 483, 223(2009). PMID:19183902
- Niwa, R., et al., Clin. Cancer Res., 10(18 Pt 1), 6248(2004). PMID:15448014
- Okazaki, A., et al., J. Mol. Biol., 336(5), 1239(2004). PMID:15037082
- Ferrara, C., et al., J. Biol. Chem., 281(8), 5032(2006). PMID:16330541
- Yamane-Ohnuki, N. and Satoh, M., Mabs., 1(3), 230(2009). PMID:20065644
- Van der Neut Kolfschoten, M., et al., Science, 317(5844), 1554(2007). PMID:17872445
- Labrijn, A.F., et al., Nat. Biotechnol., 27(8), 767(2009). PMID:19620983
- Duncan, A.R. and Winter, G., Nature, 332(6166), 738(1988). PMID:3258649
- Duncan, A.R., et al., Nature, 332(6164), 563(1988). PMID:2965792
- Hezareh, M., et al., J. Virol., 75(24), 12161(2001). PMID:11711607
- Oganesyan, V., et al., Acta. Crystallogr. D. Biol. Crystallogr., 64(Pt 6), 700(2008). PMID:18560159
- Tao, M.H. and Morrison, S.L., J. Immunol., 143(8), 2595(1989). PMID:2507634
- Mimura, Y., et al., J. Biol. Chem., 276(49), 45539(2001). PMID:11567028
- Walker, M.R., et al., Biochem. J., 259(2), 347(1989). PMID:2524188
- Mazor, Y., et al., Nat. Biotechnol., 25(5), 563(2007). PMID:17435747
- Simmons, L.C., et al., J. Immunol. Methods., 263( 1-2), 133(2002). PMID:12009210
- Hinton, P.R., et al., J. Biol. Chem., 279(8), 6213(2004). PMID:14699147
- Dall’Acqua, W.F., et al., J. Immunol., 169(9), 5171(2002). PMID:12391234
- Dall’Acqua, W.F., et al., J. Biol. Chem., 281(33), 23514(2006). PMID:16793771
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。


