S-パルミトイル化修飾解析について幅広いアプリケーションを行えます RapidSPALM, Protein S-Palmitoylation Detection Kitのアプリケーションデータ
掲載日情報:2022/09/15 現在Webページ番号:68419
追加しました。
タンパク質のS-パルミトイル化修飾を多面的に解析できるRapidSPALM, Protein S-Palmitoylation Detection Kitの幅広いアプリケーションデータをご紹介いたします。
※ RapidSPALM, Protein S-Palmitoylation Detection Kitの詳細はこちらをご覧下さい。
※ 本製品は研究用です。研究用以外には使用できません。
アプリケーションデータ一覧
表中の解析例をクリックすると、それぞれのアプリケーションデータをご覧になれます。
※ アプリケーションデータをご覧になられる前に、まずは「RapidSPALMのデータの見方」をご確認下さい。
| 解析方法 | 解析例 | 使用キット |
|---|---|---|
| 蛍光アッセイによる試料間のS-パルミトイル化修飾総量の相対比較 | マウス由来組織のS-パルミトイル化修飾総量の相対比較と特異性判定 | 反応キット |
| 培養細胞株のS-パルミトイル化修飾総量の相対比較と特異性判定(PDFで表示) | ||
| ブロッコリーの各部におけるS-パルミトイル化修飾総量の相対比較と特異性判定(PDFで表示) | ||
| 蛍光イメージャーによるSDS-PAGEゲル中のS-パルミトイル化タンパク質バンドの検出 | マウス脳試料におけるS-パルミトイル化タンパク質のSDS-PAGEゲル内検出 | 反応キット |
| ゲルシフトアッセイによる目的タンパク質のS-パルミトイル化修飾個数の判定 | マウス脳試料における代表的なS-パルミトイル化タンパク質の修飾個数判定 | 反応キット |
| 精製キットによるS-パルミトイル化タンパク質の網羅的精製と検出 | マウス由来組織におけるS-パルミトイル化タンパク質の精製と特異性判定 | 反応キット + 精製キット |
| 培養細胞株のS-パルミトイル化タンパク質の精製と特異性判定(PDFで表示) | ||
| ブロッコリー組織のS-パルミトイル化タンパク質の精製と特異性判定(PDFで表示) | ||
| 精製キットによる目的タンパク質のS-パルミトイル化修飾判定と修飾割合の算定 | マウス脳試料の代表的なS-パルミトイル化タンパク質の検出と修飾割合の算定 | 反応キット + 精製キット |
| 総合的なアプリケーション | マウス脳組織の組織分画によるS-パルミトイル化タンパク質の濃縮 | 反応キット + 精製キット |
| 培養細胞における細胞内S-パルミトイル化タンパク質分布の解析 | ||
| 培養細胞における刺激応答性の評価 | ||
| 従来方法との比較 | マウス脳組織を用いたRapidSPALM(本製品)と従来手法ABE法の比較 | 反応キット + 精製キット |
RapidSPALMのデータの見方
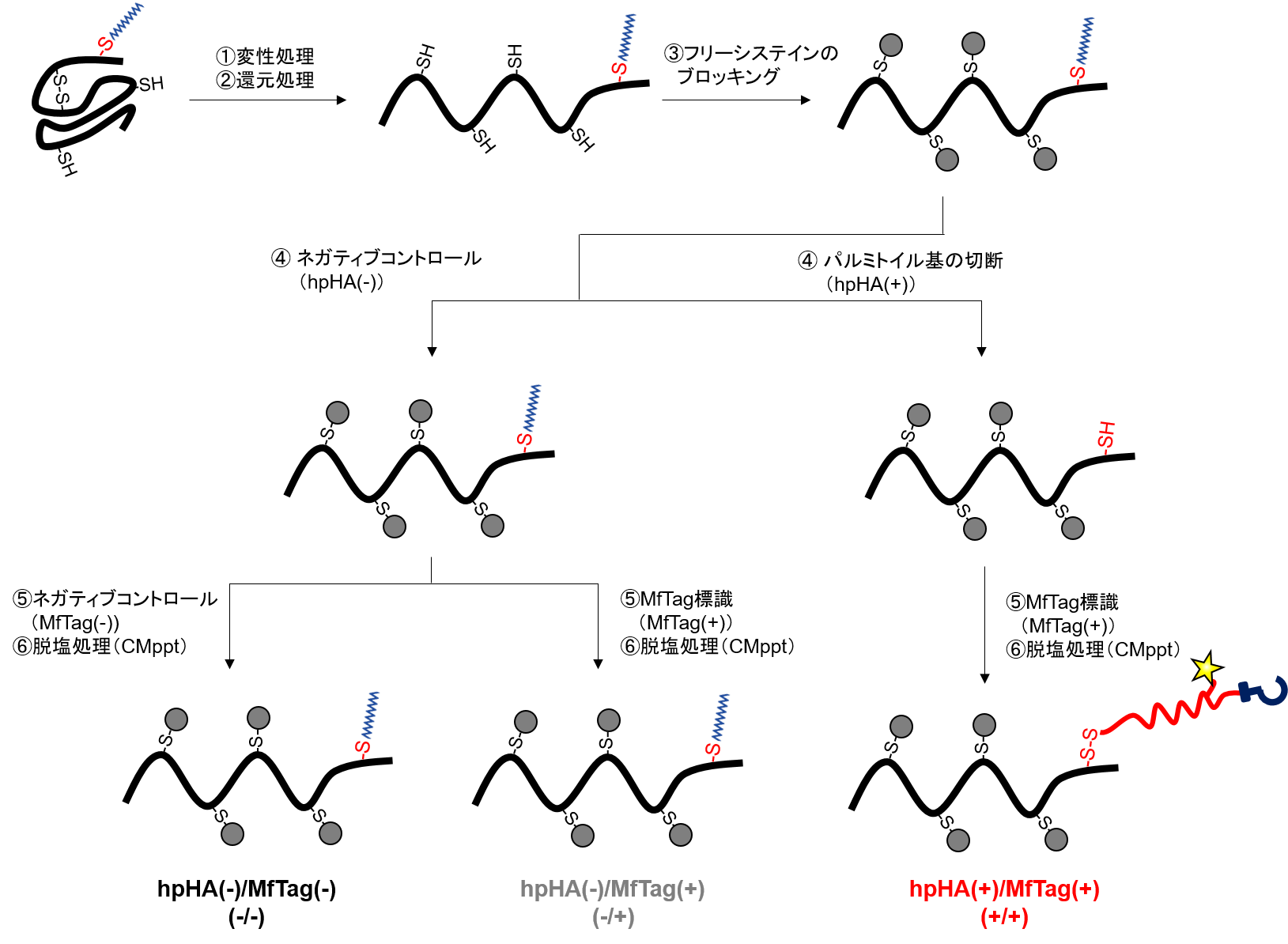
RapidSPALMにおいて、下記に示すように1試料について3つの処理hpHA(-)/MfTag(-)、hpHA(-)/MfTag(+)、hpHA(+)/MfTag(+)を行います。本アプリケーションデータ紹介ページでは、下記の段階的反応における各処理hpHA(-)/MfTag(-)、hpHA(-)/MfTag(+)、hpHA(+)/MfTag(+)をそれぞれ-/-、-/+、+/+と表記しています。それぞれの処理方法と目的は表1および表2をご覧下さい。
図をクリックすると拡大します( )
)
RapidSPALMの変換反応の模式図
表1:処理方法
| 処理の名称 | 略称 | 還元 | Cys ブロッキング |
パルミトイル 切断 |
MfTag 標識 |
脱塩 (CMppt) |
|---|---|---|---|---|---|---|
| hpHA(-)/MfTag(-) | -/- | ✔ | ✔ | ✔ | ||
| hpHA(-)/MfTag(+) | -/+ | ✔ | ✔ | ✔ | ✔ | |
| hpHA(+)/MfTag(+) | +/+ | ✔ | ✔ | ✔ | ✔ | ✔ |
表2:各処理の目的
| 処理の名称 | 略称 | 目的 |
|---|---|---|
| hpHA(-)/MfTag(-) | -/- |
|
| hpHA(-)/MfTag(+) | -/+ |
|
| hpHA(+)/MfTag(+) | +/+ |
|
非還元および還元条件の選択方法
RapidSPALMにおいて、MfTagはシステイン側鎖チオール基にジスルフィド結合で標識されるため、キット付属の還元剤で容易に除去することができます。反応キットでMfTag標識後に非還元条件下でSDS-PAGEを行うとMfTagの標識個数に応じたバンドシフトが誘導されますが、還元条件下でSDS-PAGEを行うとMfTagは除去されバンドは収束します。下記の実験目的に応じて、非還元条件下と還元条件下のいずれの条件下で実施するか選択する必要があります。
図をクリックすると拡大します( )
)
2か所MfTag標識されうるタンパク質の非還元・還元条件下の模式図
アプリケーションに応じた非還元・還元条件の選択方法
| 条件 | アプリケーション |
|---|---|
| 非還元 |
|
| 還元 |
|
| 非還元・還元両方必要 |
|
蛍光アッセイによる試料間のS-パルミトイル化修飾総量の相対比較
※ 蛍光アッセイの解析方法・データの見方はこちらをご確認下さい。
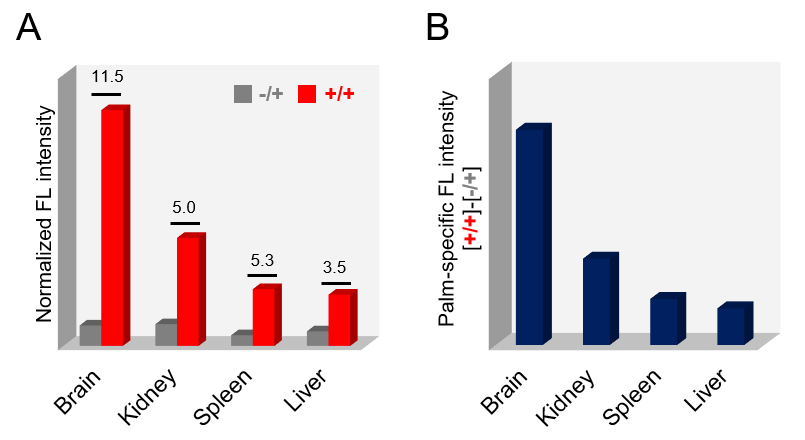
実施例:マウス由来組織のS-パルミトイル化修飾総量の相対比較と特異性判定
試料:成体マウスから摘出した脳、腎臓、脾臓、肝臓
ライセート調製方法:トータル組織ライセート
使用したキット:反応キット
スタート試料量:200 μg/1処理
蛍光イメージャーによるSDS-PAGEゲル内のS-パルミトイル化タンパク質バンドの検出
実施例:マウス脳試料におけるS-パルミトイル化タンパク質のSDS-PAGEゲル内検出
試料:成体マウスから摘出した脳組織
ライセート調製方法:トータル組織ライセート
使用したキット:反応キット
スタート試料量:200 μg/処理
電気泳動条件:非還元条件(MfTag標識を維持)
※ 非還元・還元条件の選択方法はこちらをご覧下さい。
検出方法:銀染色および蛍光イメージャー検出(Ex 312 nm/Em >560 nm)
ゲルシフトアッセイによる目的タンパク質のS-パルミトイル化修飾個数の判定
※ ゲルシフトアッセイの評価方法はこちらをご確認下さい。
実施例:マウス脳試料における代表的なS-パルミトイル化タンパク質の修飾個数判定
試料:成体マウスから摘出した脳組織
ライセート調製方法:トータル組織ライセート
使用したキット:反応キット
スタート試料量:200 μg/処理
電気泳動条件:非還元条件(MfTag標識を維持)
※ ゲル濃度は、画像中それぞれの因子名の下のカッコ内をご参照下さい。
※ 非還元・還元条件の選択方法はこちらをご覧下さい。
検出方法:PVDFメンブレンに転写後、各種特異的抗体を用いてウエスタンブロットを実施
図をクリックすると拡大します( )
)
マウス脳試料における代表的なS-パルミトイル化タンパク質の修飾個数判定
※ 画像中の*は抗体の非特異的な検出を示す。
マウス脳組織ライセートに対して反応キットを用いて-/-、-/+、+/+の3種類の処理を行った。反応後、各処理試料をMfTagが維持されるよう非還元条件下にて各因子の分子量にあったゲル濃度でSDS-PAGEを実施し、PVDFメンブレンに転写した後、代表的なパルミトイル化タンパク質に対する特異的抗体を用いたウエスタンブロットで検出した。
いずれの因子においても+/+のみでバンドシフトが観察され、-/+ではバンドシフトが見られていないため、S-パルミトイル化修飾特異的な変換反応が確認できた。マウス脳組織においてHrasは2つ、GNAQは2つ、Flotillin-2は4つ、Fynは2つ、Calnexinは2つ、PSD95は2つのMfTag、すなわちS-パルミトイル基を有すると推定された。なお、GluN2Bは分子量約150 kDaで、+/+特異的にスメア状のバンドシフトが観察されたが、MfTagの標識個数の判定はできなかった。
精製キットによるS-パルミトイル化タンパク質の網羅的精製と検出
※ 精製キットによる各種評価方法はこちらをご確認下さい。
実施例:マウス由来組織におけるS-パルミトイル化タンパク質の精製と特異性判定
試料:成体マウスから摘出した脳、腎臓、脾臓、肝臓
ライセート調製方法:トータル組織ライセート
使用したキット:反応キット+精製キット
スタート試料量:200 μg/1処理
精製カラムにアプライしたタンパク質量:100 μg/1処理
電気泳動条件:還元条件(MfTag標識を除去)
※ 非還元・還元条件の選択方法はこちらをご覧下さい。
図をクリックすると拡大します( )
)
マウス由来組織におけるS-パルミトイル化タンパク質の精製と特異性判定
A:精製キットによるMfTag標識タンパク質の精製作業後、4種類の組織の+/+処理のカラム精製前試料(Input、10倍希釈)およびカラム溶出画分(Elution、原液)を同液量ずつ還元条件下で電気泳動し精製量を比較した。4種類の組織では脳組織で最も多く精製されていることがわかる。
B:精製キットによるMfTag標識タンパク質の精製作業後、4種類の組織それぞれの3処理(-/-、-/+、+/+)のカラム精製前試料(Input、20倍希釈)およびカラム溶出画分(Elution、原液)を同液量ずつ還元条件下で電気泳動し、銀染色で検出した。いずれの組織においても+/+特異的な精製タンパク質が多数観察された。
注:肝臓では、30kDa付近の一部のタンパク質が-/-でもカラム精製されているのが確認できる。このようなタンパク質はカラム吸着性のある非特異成分である。
精製キットによる目的タンパク質のS-パルミトイル化修飾判定と修飾割合推定
実施例:マウス脳試料の代表的なS-パルミトイル化タンパク質の検出と修飾割合推定
試料:成体マウスから摘出した脳
ライセート調製方法:トータル組織ライセート
使用したキット:反応キット+精製キット
スタート試料量:200 μg/1処理
精製カラムにアプライした量:100 μg/1処理
電気泳動条件:還元条件(MfTag標識を除去、図A、B、C-左)および非還元条件(MfTag標識を維持、図C-右)
※ 非還元・還元条件の選択方法はこちらをご覧下さい。
図をクリックすると拡大します( )
)
マウス脳試料の代表的なS-パルミトイル化タンパク質の検出と修飾割合推定
A:精製キットによるMfTag標識タンパク質の精製操作後、カラム精製前試料(Input、10倍希釈)、カラム素通画分(Flow through(FT)、10倍希釈)、カラム溶出画分(Elution、原液)を同液量ずつ還元条件下で電気泳動し、銀染色で検出した。総タンパク質量に差がみられない中、+/+ に特異的な精製タンパク質が多数検出された。
B:精製キットによるMfTag標識タンパク質の精製操作後、Input、FT、Elution(いずれも原液)を同液量ずつ還元条件下で電気泳動し、PVDFメンブレンへ転写した後、7種類の代表的なパルミトイル化タンパク質の各特異的抗体を用いてウェスタンブロットで検出を行った。各タンパク質のInput、FT、Elutionは同一メンブレン上で、データを取得した。いずれのタンパク質についても+/+特異的にElutionで検出された。
C:精製キットによるMfTag標識タンパク質の精製操作後、Input、FT、Elution(いずれも原液)を同液量ずつ還元条件下(左)、および非還元条件下(右)で電気泳動し、PVDFメンブレンへ転写した後、代表的なパルミトイル化タンパク質であるPSD95とCalnexinの特異的な抗体を用いてウェスタンブロットで検出を行った。まず、非還元条件(右)を見ると、PSD95、CalnexinともにMfTag標識済みのバンドはFTには見られず、Elutionのみ観察されたため、カラム精製が良好に完了していることがわかる。このようなケースにおいて、還元条件(左)でFTとElutionの存在量を比較することで、S-パルミトイル化修飾存在量を推察することができ、PSD95、Calnexinともに大部分がS-パルミトイル化体であることが推定された。
総合的なアプリケーション例
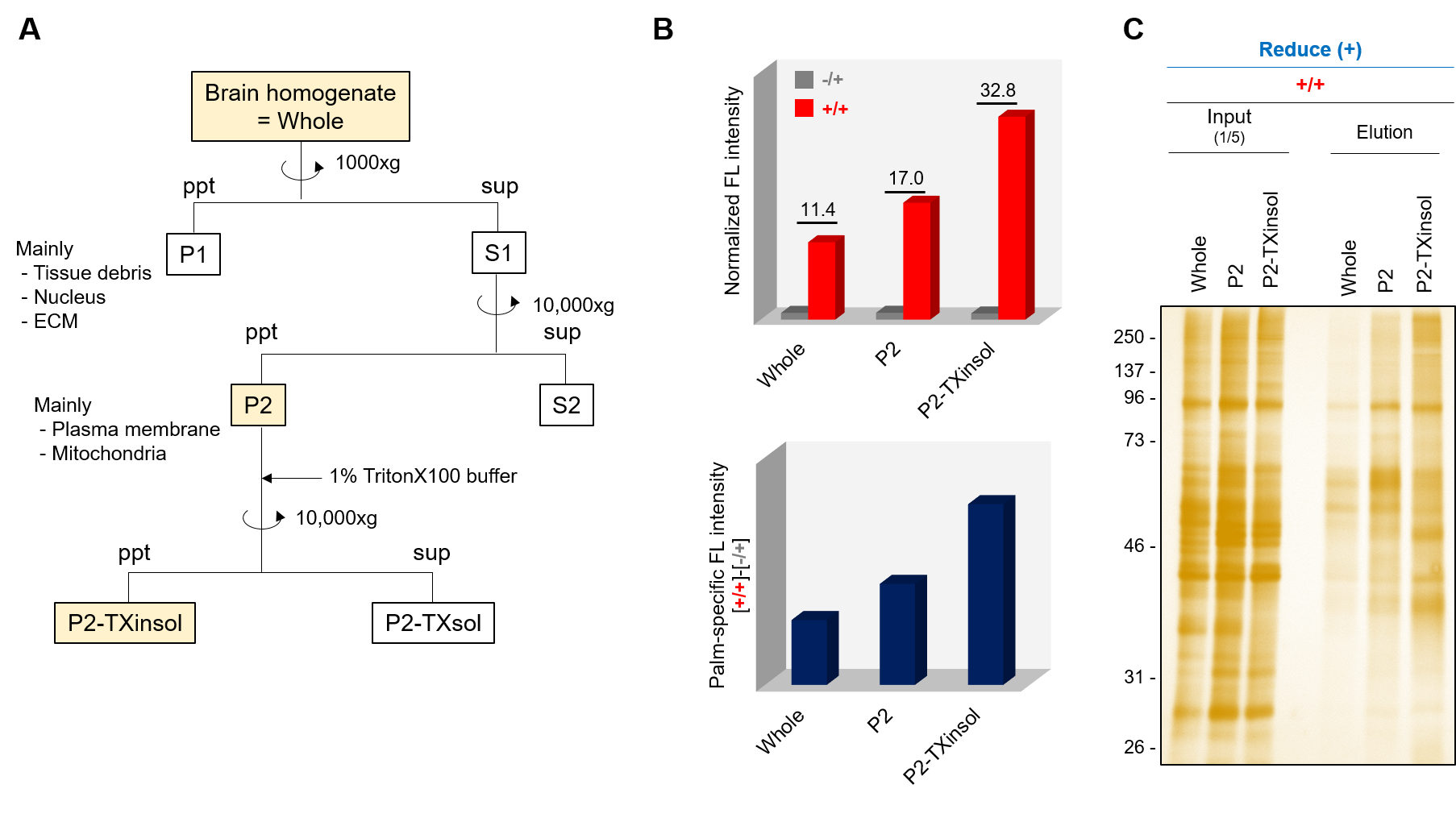
実施例:マウス脳組織の組織分画によるS-パルミトイル化タンパク質の濃縮
事前の試料調製:図Aに沿ってマウス脳組織からP2膜画分およびP2-Triton X100不溶性画分(P2-TXinsol)を取得した。
使用したキット:反応キット+精製キット
分析方法:蛍光アッセイ、カラム精製溶出物の銀染色
スタート試料量:100 μg/1処理
精製カラムにアプライした量:50 μg/1処理
電気泳動条件:還元条件(MfTag標識を除去)
※ 非還元・還元条件の選択方法はこちらをご覧下さい。
図をクリックすると拡大します( )
)
マウス脳組織の組織分画によるS-パルミトイル化タンパク質の濃縮
A:P2およびP2-TXinsol画分の取得方法。マウス全脳を界面活性剤不含破砕バッファー(50 mM Phosphate (pH 7.4), 150 mM NaCl, 320 mM Sucrose)中にてダウンス型ホモジナイザーで破砕後、低速遠心分離にてP1画分を沈殿として除去した後、上清S1を中速遠心分離にかけた。沈殿をP2画分として回収し、さらにP2画分の半分に1% Triton X100バッファーを添加して可溶化後、中速遠心分離でTriton X100可溶性画分(P2-TXsol)と不溶性画分(P2-TXinsol)に分画した。回収したP2およびP2-TXinsol画分に1× Basal bufferを添加し可溶化して反応キットに使用した。
B:蛍光アッセイによる各試料のhpHA特異性の評価(上)および各試料間のパルミトイル化量の相対比較(下)。全脳組織に比べP2画分、P2-TXinsol画分でパルミトイル化タンパク質が濃縮しているのが確認できる。
C:精製キットによる精製作業後、各+/+のカラム精製前試料(Input、5倍希釈)およびカラム溶出画分(Elution、原液)を同液量ずつ還元条件下で電気泳動し、銀染色で検出した。精製されたタンパク質が全脳組織に比べP2画分、P2-TXinsol画分でパルミトイル化タンパク質が濃縮しているのが確認できる。
実施例:培養細胞における細胞内S-パルミトイル化タンパク質分布の解析
事前の試料調製:図Aに沿ってNeuro2a細胞からトータル細胞ライセート、P10k画分(主に細胞膜)、S10k画分(主に小胞体膜および細胞質)を取得した。
使用したキット:反応キット+精製キット
分析方法:蛍光アッセイ、カラム精製溶出物の銀染色
スタート試料量:100 μg/1処理
精製カラムにアプライした量:50 μg/1処理
電気泳動条件:還元条件(MfTag標識を除去)
※ 非還元・還元条件の選択方法はこちらをご覧下さい。
図をクリックすると拡大します( )
)
培養細胞における細胞内S-パルミトイル化タンパク質分布の解析
A:Neuro2a由来各ライセートの調製方法。"Whole"はNeuro2aに直接1× Basalbufferを添加してライセートを調製した。一方、分画用として界面活性剤不含の破砕バッファー(50 mM Phosphate (pH7.4), 150 mM NaCl, 320 mM Sucrose)により細胞を懸濁後、超音波破砕を行い、中速遠心分離(10,000×g、20分間、4℃)により沈殿画分(P10k)および上清画分(S10k)を取得した。各試料のバッファーを統一するため、それぞれCMpptを一度実施し、いずれも1x Basal Bufferに置換した後、反応キットに使用した。
B:蛍光アッセイによる各試料のhpHA処理特異性の評価。
C:総タンパク質量の割合(左)と蛍光アッセイを基にした各試料のS-パルミトイル化修飾量の割合(右)。本分画実験ではS10kにS-パルミトイル化タンパク質が相対的に多く含まれていた。
D:精製キットによる精製作業後、各+/+のカラム精製前試料(Input、20倍希釈)およびカラム溶出画分(Elution、原液)を同液量ずつ還元条件下で電気泳動し、銀染色で検出した。精製されたタンパク質がトータル細胞ライセートに比べS10kにS-パルミトイル化タンパク質が濃縮しているのが確認できる。
実施例:培養細胞における刺激応答性の評価
事前の試料調製:図Aに沿ってNeuro2a細胞に4種類の薬剤(パルミトイル転移酵素(PAT)阻害物質(10 μM 2-Bromopalmitate + 10 μM Cerulenin)、一酸化窒素(NO)ストレス(1 mM SNAP)、小胞体(ER)ストレス(1 μg/ml Tunicamycine)および細胞膜脱分極(50 mM KCl))を24時間処理し、細胞を回収後、細胞膜粗精製画分(P10k)を粗精製した。
使用したキット:反応キット+精製キット
分析方法:蛍光アッセイ、カラム精製溶出物の銀染色
スタート試料量:100 μg/1処理
精製カラムにアプライした量:50 μg/1処理
電気泳動条件:還元条件(MfTag標識を除去)および非還元条件(MfTag標識を維持)
※ 非還元・還元条件の選択方法はこちらをご覧下さい。
図をクリックすると拡大します( )
)
培養細胞における刺激応答性の評価
A:実験プロトコルの概要
B:蛍光アッセイによる各+/+試料の蛍光値を測定後、コントロール処理の蛍光値に対する各刺激処理の蛍光値を比較した。いずれも蛍光量(=S-パルミトイル化修飾総量)の変動が確認でき、特にNOストレスにおいて顕著な減少が確認された。
C:精製キットによる精製作業後、各+/+試料のカラム精製前試料(Input)とカラム溶出画分(Elution)を還元条件下および非還元条件下で電気泳動し、銀染色で検出した。いずれの条件下においてもNOストレス処理により精製タンパク質の大きな変動が観察された。
参考:従来手法ABE法との比較
実施例:マウス脳組織を用いたRapidSPALMと従来手法ABE法の比較
試料:成体マウスから摘出した脳組織
ライセート調製方法:トータル組織ライセート
使用したキット:反応キット+精製キット
スタート試料量:200 μg/処理
精製カラムにアプライした量:各変換反応終了後の総タンパク質の半量相当
電気泳動条件:還元条件(MfTag(RapidSPALMの場合)、biotin(ABE法の場合)をそれぞれ除去)
※ 非還元・還元条件の選択方法はこちらをご覧下さい。
図をクリックすると拡大します( )
)
RapidSPALMと従来手法ABE法の比較
A:比較実験プロトコル
ABE法は一般的なプロトコルを採用し、CMpptは計8回(ブロッキング後5回+ビオチン標識後3回)実施した。RapidSPALMはキットプロトコルを使用し、CMpptは計2回実施した。
B:それぞれ変換反応終了時の総タンパク質量の評価、銀染色(左)とBCAアッセイによる損失率の算定(右)
RapidSPALMはCMppt回数の削減により総タンパク質の損失を抑えるとともに、電気泳動におけるスメア化が抑えられた。
C:各精製作業後の溶出画分の銀染色での検出
RapidSPALMはABE法に比べ精製量が大幅に向上していることがわかる。量比のより正確な比較のため、RapidSPALMは5倍希釈しABEと比較したところ、銀染色において同程度の染色強度が得られため、RapidSPALMはABE法の5倍程度感度向上が見積もられた。
価格
[在庫・価格 :2026年03月10日 11時35分現在]
| 詳細 | 商品名 |
|
文献数 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
RapidSPALM, Protein S-Palmitoylation Detection Kit |
|
0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
RapidSPALM, Additional Components for Affinity Purification |
|
0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
[在庫・価格 :2026年03月10日 11時35分現在]
RapidSPALM, Protein S-Palmitoylation Detection Kit
文献数: 0
- 商品コード:F017A
- メーカー:BDL
- 包装:12assays
- 価格:¥80,000
- 在庫:3個以上
- 納期:2~3週間 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | タンパク質S-パルミトイル化修飾(S-palmitoylation)を解析するキット。S-パルミトイル基を多機能タグに化学変換することで,相対定量,修飾個数判定が可能。また,別売品#F017Bと組み合わせることで,網羅的精製と目的タンパク質の同定・修飾割合算定ができる。 |
||
|---|---|---|---|
| 法規制等 | |||
| 保存条件 | -20℃ | 法規備考 | |
| 掲載カタログ |
ニュース2023年10月15日号 p.24 ニュース2025年5月合併号 p.17 ニュース2024年3月15日号 p.15
|
||
| 製品記事 | RapidSPALM, Protein S-Palmitoylation Detection Kit バイオダイナミクス研究所 製品特集 |
||
| 関連記事 | タンパク質の抽出・精製製品特集 |
||
RapidSPALM, Additional Components for Affinity Purification
文献数: 0
- 商品コード:F017B
- メーカー:BDL
- 包装:24columns
- 価格:¥40,000
- 在庫:3個以上
- 納期:2~3週間 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | タンパク質S-パルミトイル化修飾(S-palmitoylation)を解析するキット(#F017A)の精製用追加コンポーネント。#F017Aで調製した試料に対して使用することで,S-パルミトイル化タンパク質を迅速に精製でき,網羅的精製と目的タンパク質の同定・修飾割合算定に利用できる。注:本製品#F017Bのみでは実験できません。#F017Aと組み合わせる必要があります。 |
||
|---|---|---|---|
| 法規制等 | |||
| 保存条件 | 4℃ | 法規備考 | |
| 掲載カタログ |
ニュース2024年7月15日号 p.37 ニュース2023年8月合併号 p.42 ニュース2023年10月15日号 p.24
|
||
| 製品記事 | RapidSPALM, Protein S-Palmitoylation Detection Kit バイオダイナミクス研究所 製品特集 |
||
| 関連記事 | タンパク質の抽出・精製製品特集 |
||
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。