HOME
>
試薬
>
細胞培養
>
細胞培養一般試薬
>
細胞/組織培養用基材
>
Xona Microfluidics社ニューロンの形態観察用チャンバー「Neuron Device」の使用方法[参考資料]
HOME
>
試薬
>
神経/イオンチャネル
>
神経科学関連商品
>
Xona Microfluidics社ニューロンの形態観察用チャンバー「Neuron Device」の使用方法[参考資料]
Xona Microfluidics社ニューロンの形態観察用チャンバー「Neuron Device」の使用方法[参考資料]
掲載日情報:2015/11/12 現在Webページ番号:56156
Xona Microfluidics社ニューロンの形態観察用チャンバー「Neuron Device」の使用方法です。
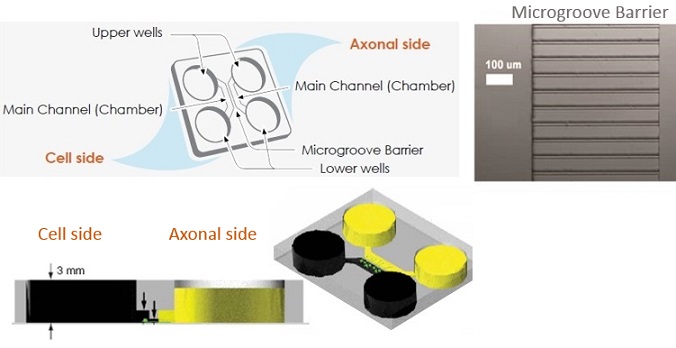
本製品は使用前に洗浄、カバーガラスへの接着、Poly-L-Lysine処理を行う必要があり、その際にプラズマ洗浄装置を用いる方法(Plasma Bonding)と用いない方法(Non-plasma Bonding)があります。
追加しました。
- Plasma BondingとNon-plasma Bondingの比較
- プラズマ洗浄装置を用いる方法(Plasma Bonding)での使用法
- プラズマ洗浄装置を用いない方法(Non-plasma Bonding)での使用法
Plasma BondingとNon-plasma Bondingの比較
| プラズマ洗浄装置を用いる方法 (Plasma Bonding) |
プラズマ洗浄装置を用いない方法 (Non-plasma Bonding) |
|---|---|
|
|
追加しました。
プラズマ洗浄装置を用いる方法(Plasma Bonding)での使用法
※細胞の播種以前の操作は、エタノール滅菌をしたバイオセーフキャビネット中で行って下さい。
- カバーガラス(Corning No.1、24×40mmなど)を滅菌水に浸し、超音波洗浄を30分間行う。70%エタノールで1回、滅菌水で3回リンス後、風乾させる。
Neuron Deviceを70%エタノールでリンス後、風乾させる。
※Neuron Deviceはオートクレーブ滅菌も可能ですが、オートクレーブ用コンテナやバッグがプラスチック製の場合、細胞に有害な成分が溶け出しNeuron Deviceに付着する場合があります。
適切な容器にカバーガラスとNeuron Deviceを置き、プラズマ洗浄装置で圧力300~500mTorr、2分間の条件で処理する。 - プラズマ洗浄装置から取り出した後、カバーガラス上にNeuron Deviceを置き、Neuron Deviceを均一に軽く押し、着実に接着させる。
- Neuron Deviceを滅菌した60mm培養用ディッシュにセットし、Neuron Deviceの細胞体側のMain Channelが左、軸索側のMain Channelが右になるようにして、これ以降の操作を行う。Neuron Deviceの左上のウェルに0.5mg/mlのPoly-L-Lysine(PLL)溶液を150μl加え、Main Channelへ流し込んだ後、5分間インキュベートし、更に左下のウェルにPLL溶液を150μl加えた後、5分間インキュベートする。右側のウェルにも同様にPLL溶液を加えた後、4時間以上インキュベートする。
- 各ウェルからピペットにより溶液を吸引する。その際に、Main Channel内の溶液は吸引せず、気泡が入らないようにする(以下同様に)。
- 滅菌水を左上、右上のウェルに150μlずつ加え、それぞれのMain Channelへ流し込んだ後、各ウェルからピペットにより溶液を吸引する。この操作を3回繰り返す。
- 滅菌水を左上、右上のウェルに150μlずつ加え、それぞれのMain Channelへ流し込んだ後、37℃で1時間以上インキュベートし、各ウェルからピペットにより溶液を吸引する。この操作を3回繰り返す。
- NBM(Neural Basal Media)などの適切な培地を左上のウェルに150μl加え、Main Channelへ流し込み、5分間インキュベートする。さらに左下のウェルに培地を150μl加え、5分間インキュベートする。右側のウェルにも同様に培地を加えた後、各ウェルからピペットにより溶液を吸引する。再度新しい培地を左上、右上のウェルに150μlずつ加え、それぞれのMain Channelへ流し込んだ後、5分間インキュベートする。
- 37℃で3時間以上インキュベートし、各ウェルからピペットにより溶液を吸引する。
- 実験動物から採取、分散させた2.5~4.5×106cells/mlの初代ニューロン20μlを左上のウェルに加え、Main Channelへ流し込む。細胞がMain Channelへ流し込まれたことを顕微鏡で確認した後、37℃、5% CO2で10分間インキュベートする。
- 培地を左上、右上のウェルに150μlずつ加え、30秒から1分間インキュベートして、それぞれのMain Channelへ流し込む。
- 培地を左下、右下のウェルに150μlずつ加え、インキュベーターに戻す。
- 24時間後、培地交換を行う。
追加しました。
プラズマ洗浄装置を用いない方法(Non-plasma Bonding)での使用法
※細胞の播種以前の操作は、エタノール滅菌をしたバイオセーフキャビネット中で行って下さい。
- Neuron Deviceを70%エタノールでリンス後、風乾させる。
※Neuron Deviceはオートクレーブ滅菌も可能ですが、オートクレーブ用コンテナやバッグがプラスチック製の場合、細胞に有害な成分が溶け出しNeuron Deviceに付着する場合があります。
- カバーガラス(Corning No.1、24×40mmなど)を滅菌水に浸し、超音波洗浄を30分間行う。70%エタノールで1回、滅菌水で3回リンス後、風乾させる。 0.5mg/mlのPoly-L-Lysine(PLL)溶液に浸し、4時間以上インキュベートする。滅菌水で数回リンス後、滅菌水に浸し3時間以上インキュベートする。滅菌水で数回リンス後、風乾させる。
- カバーガラス上にNeuron Deviceを置き、ガラスを割らないように慎重かつしっかりとNeuron Deviceを押す。
- Neuron Deviceを滅菌した60mm培養用ディッシュにセットし、Neuron Deviceの細胞体側のMain Channelが左、軸索側のMain Channelが右になるようにして、これ以降の操作を行う。NBM(Neural Basal Media)などの適切な培地を左上のウェルに150μl加え、30秒から1分間インキュベートしてMain Channelへ流し込んだ後、左下のウェルに培地を150μl加え、37℃、5% CO2で1時間インキュベートする。右側のウェルにも同様に培地を加える。
- 各ウェルからピペットにより培地を除去した後、実験動物から採取・分散させた2.5~4.5×106cells/mlの初代ニューロン20μlを左上のウェルに加え、Main Channelへ流し込む。細胞がMain Channelへ流し込まれたことを顕微鏡で確認した後、37℃、5% CO2で10分間インキュベートする。
- 150μlずつの培地を左上、右上の順で各ウェルに加えた後、30秒間インキュベートして、それぞれのMain Channelへ流し込む。次いで培地を150μlずつ左下、右下の順で各ウェルに加え、インキュベーターに戻す。
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。


