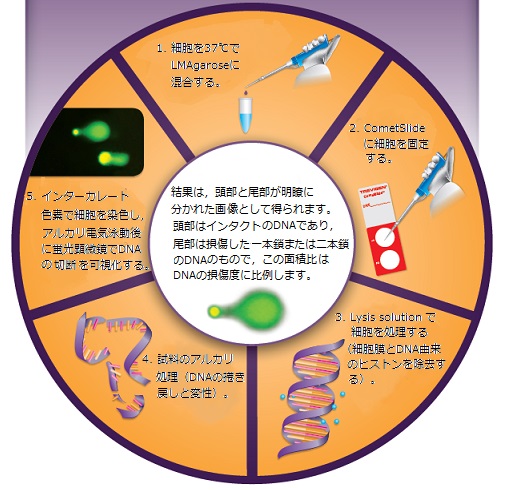
これを読めば、コメットアッセイがすぐにわかる! R&D Systems製品 CometAssay KitについてのFAQ
掲載日情報:2019/05/23 現在Webページ番号:80576
R&D Systems製品 CometAssay KitおよびComet Control Cellsについて、よくお問い合わせを受ける質問&回答(FAQ)についてご紹介します。
下図をクリックするとR&D Systems製品 CometAssay Kitの製品の詳細をご覧いただけます。
カートに商品を
追加しました。
追加しました。
CometAssay KitについてのFAQ
個々の質問番号(Q1.、Q2.、...)に対する、それぞれの回答番号(A1.、A2....)をクリックすると、詳細をご覧いただけます。
Q1. CometAssayは固形組織でも使用できますか?使用できるのであれば、どのようにするのでしょうか?
A1.
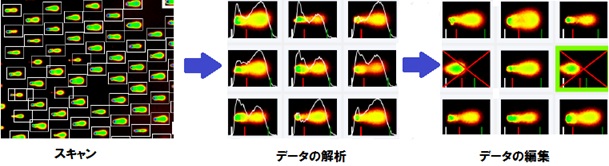
Q3. CometAssayの評価に利用できる画像解析ツールは何ですか?
A3.
A3.
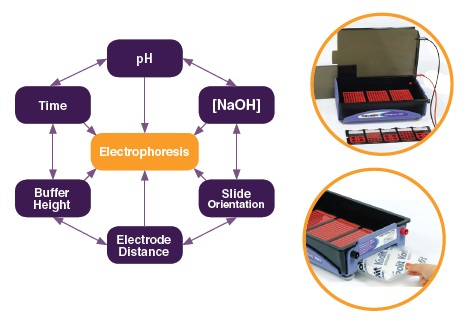
Q4. ポジティブコントロール(過酸化水素など)でComet tailが見られません。
A4.
A4.
カートに商品を
追加しました。
追加しました。
製品の種類
製品カテゴリーをクリックすると製品の詳細、商品コードをクリックすると各製品の価格表をご覧いただけます。
| 製品カテゴリー | 品名 | 包装 | 商品コード |
|---|---|---|---|
| Starter Kit | Comet Assay Electrophoresis System II | 1 Kit | 4250-050-ES |
| CometAssay 2 Well ES Unit with Starter Kit | 1 Kit | 4250-050-ESK | |
Software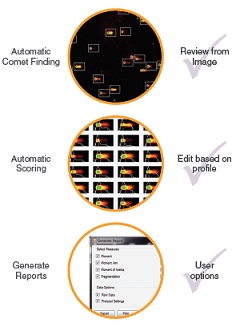 |
Comet Analysis Software | 1 license | 4260-000-CS |
Control Cells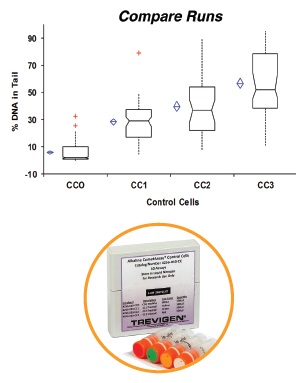 |
CometAssay Alkaline Control Cells | 1 set (10 assays) | 4256-010-CC |
Slides and Rack System |
FLARE Slide (3 Well) | 25 slides | 3950-075-02 |
| 100 slides | 3950-300-02 | ||
| CometAssay Reagent Kit | CometAssay Kit (25 x 2 Well Slides) | 1 Kit (50 tests) |
4250-050-K |
| CometAssay Silver Kit (2 Well Slides) | 1 Kit (50 tests) |
4251-050-K | |
| CometAssay Silver Staining Components | 1 Kit (200 tests) |
4254-200-K | |
| CometAssay Reagent | CometAssay Lysis Solution | 100 ml | 4250-010-01 |
| 2×500 ml | 4250-050-01 | ||
| CometAssay LMAgarose | 15 ml | 4250-050-02 | |
| 100 ml | 4250-500-02 | ||
| 200 mM EDTA, pH 10 | 12.5 ml | 4250-050-04 |
カートに商品を
追加しました。
追加しました。
Comet Assay Systemフライヤー
下の画像をクリックすると、Comet Assay Systemフライヤーのフライヤー(PDF)をダウンロードいただけます。
カートに商品を
追加しました。
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。