R&D Systems(R&Dシステムズ)社 ELISA用ペア抗体を使用したELISA 構築ガイド
掲載日情報:2017/09/01 現在Webページ番号:80556
R&D Systems(R&Dシステムズ)社のELISA用ペア抗体を使用したELISA 構築ガイドです。ELISA構築に必要なプレートやバッファー、およびELISA プロトコルなどをご紹介しています。
※ R&D Systems社構築型ELISAキットDuoSet Kitは、「R&D Systems Quantikine ELISA Kit/DuoSet Kit特集」をご覧下さい。
※ DuoSetキットでは、抗体濃度等の条件検討は不要です。
追加しました。
-
2025/12/01
試薬 特別価格
[RSD]厳選 抗体&リコンビナントタンパク質 30%OFFキャンペーン[~2026/02/27]
期間:2025/12/01 ~2026/02/27
R&D Systems, Inc.(RSD)
ELISA 構築に必要な消耗品/装置
- ELISA microtiter plate(R&D Systems 社 #DY990, Costar 社 #2592 または同等の製品)
- Disposable plate sealer(R&D Systems 社 #DY992, Costar 社 #3095 または同等の製品)
- Disposable reagent reservoir
- Assorted graduated cylinder
- Wash bottle and / or automatic plate washer
- Assorted adjustable volume pipette
- 8 or 12 channel multichannel pipette
- Pipette tip
- Assorted volume pipette
- Polypropylene tube(R&D Systems 社 #DY990 など)
- ELISA plate reader with optional data reduction software
追加しました。
ELISA 構築に必要な試薬
- Wash buffer(R&D Systems 社 #WA126 または0.05% Tween-20 in PBS, pH 7.4)
- Diluent(R&D Systems 社 #DY004, #DY995, #DY997 など:各抗体のプロトコルを参照)
- Detection system(例:Streptavidin-HRP(R&D Systems 社 #DY998)、Color Reagent A(H2O2 )and Color Reagent B(TMB)(R&D Systems 社 #DY999))
- Stop solution(R&D Systems 社 #DY994 など:検出系に基づく)
※ R&D Systems社構築型ELISAキットDuoSet Kitで使用する別売品セットは、「DuoSetに必要な別売品セット(DuoSet Ancillary Reagent Kit)/その他別売品」をご覧下さい。
追加しました。
ELISA プロトコル(参考資料)
※ 抗体など各種製品を使用する前には、必ずデータシートや試験成績書(COA, Certificate of Analysis)をご確認下さい。
プレートの準備
- 1 ウェル当たり100 μl の捕捉用抗体をELISA プレートに添加して下さい(PBS で適切な濃度に希釈した抗体は、希釈後すぐに使用して下さい)。プレートをシールし、室温で一晩インキュベーションして下さい。
- 各ウェルの抗体溶液を吸引し、400 μl のWash buffer で洗浄して下さい。この洗浄操作は最低3 回行って下さい。洗浄用ボトル、マルチチャネルピペット、マニフォールドディスペンサーまたはオートウォッシャーを用いて、Wash buffer を各ウェルに十分に満たして下さい。正確な結果を得るために、洗浄に用いた試薬を完全に除去することが重要です。最後の洗浄の後、ウェル内に残っているWash buffer を吸引し、さらにプレートを逆さにして、ペーパータオルの上で叩いて除去して下さい。
- 推奨のBlocking buffer 300 μl (詳細は製品添付のデータシートをご覧下さい)を各ウェルに加え、プレートのブロッキングを行って下さい。室温で最低1 時間インキュベーションして下さい。
- 2 . と同様の吸引/洗浄を行って下さい。これらの操作を経て、プレートに試料を添加する準備が整ったことになります。
アッセイの手順
- 濃度未知の試料およびスタンダードの希釈は、ポリプロピレンチューブで行って下さい。適切な希釈液で希釈した試料またはスタンダード100 μ l を各ウェルに添加して下さい。プレートのフレームを軽く叩き、1 分間混合して下さい。プレートシーラーでウェルをカバーし、室温で2 時間インキュベートして下さい。
- 「 プレートの準備」の2 . と同様の吸引/洗浄を行って下さい。
- 適切な希釈液で希釈したビオチン標識検出用抗体100 μl を、各ウェルに添加して下さい。新しいプレートシーラーでウェルをカバーし、室温で2 時間インキュベートして下さい。
- 「 プレートの準備」の2 . と同様の吸引/洗浄を行って下さい。
- Streptavidin-HRP(R&D Systems 社 #DY998:バイアルのラベルの指示に従って希釈したもの)100 μl を各ウェルに添加して下さい。 プレートをカバーし、室温で20 分間インキュベートして下さい。HRP 以外の検出系を用いることも可能です。プレートを遮光して下さい。
- 「 プレートの準備」の2 . と同様の吸引/洗浄を行って下さい。
- Substrate solution(R&D Systems 社 #DY999)100 μl を各ウェルに添加して下さい。室温で20 ~ 30 分間インキュベートして下さい。プレートを遮光して下さい。
- Stop solution 50 μl を各ウェルに添加して下さい。プレートを軽く叩き、試薬を十分に混合して下さい。
- 30 分以内に各ウェルの吸光度(O.D.)を測定して下さい。Substrate solution またはTMB を使用している場合は、プレートリーダーを450 nm に設定して下さい。プレートリーダーにて自動的に補正が可能な場合は、補正用の波長を540 nm または570 nm に設定して下さい。自動的にできない場合は、450 nm の測定値から540 nm または570 nm の測定値を差し引いて補正値として下さい。補正をせずに450 nm の測定値を用いると、実際よりも高い値となり、正確さを欠くことがあります。
アッセイの最適化
抗体濃度 :捕捉用抗体および検出用抗体の最適濃度を決める最良の方法は、“格子実験”です。格子実験とは、1 枚のプレート内で様々な濃度の抗体のペアを用い、使用に最適な濃度を決める方法です。この実験に用いる抗体濃度は、各抗体の種類(モノクローナルまたはポリクローナル)によって異なります。表1 は、最初の条件検討を行う際に推奨される濃度条件です。
| 捕捉用モノクローナル抗体または検出用ポリクローナル抗体の濃度 | |||
| 捕捉用モノクローナル抗体の濃度 | 1, 2, 4, 8 μg/ml | 0.5, 1, 2, 4 μg/ml | 0.2, 0.4, 0.8 μg/ml |
| 検出用ポリクローナル抗体の濃度 | 50, 100, 200, 400 ng/ml | 0.25, 0.5, 1, 2 ng/ml | 50, 100, 200, 400 ng/ml |
表1:最初の条件検討に推奨される抗体濃度条件
各抗体の濃度条件に基づいて、96 ウェルプレートを図1 のように4 等分します。
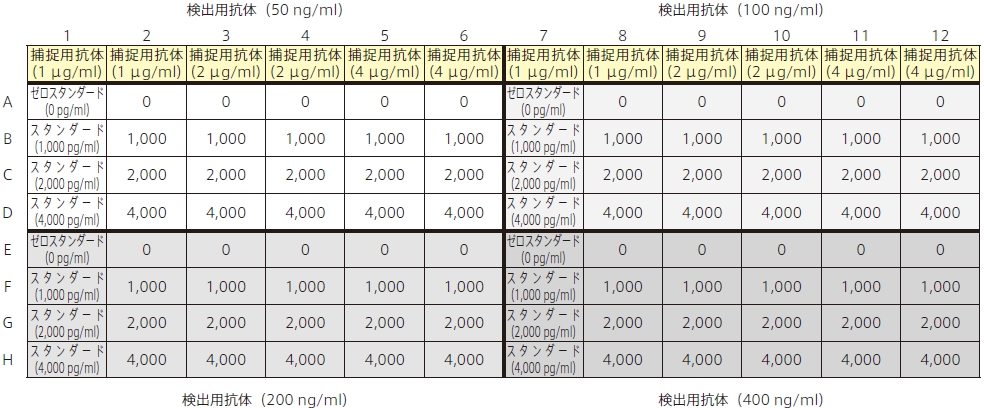
図1:格子実験における捕捉用モノクローナル抗体と検出用ポリクローナル抗体の濃度条件
数多くの濃度条件の組み合わせから、最良のS/N 比を選択します。ゼロスタンダードから、各抗体濃度のペアで “ノイズ”すなわちバックグラウンド値を知ることができます。1,000、2,000 および4,000 pg/ml のスタンダードから、各抗体濃度のペアで“シグナル”の値を知ることができます。これらの結果から、バックグラウンドの値を許容でき、かつ最大のS/N 比を有した条件を選択できます。S/N 比は10 が望ましいですが、最低でも5 以上は必要です。
バックグラウンド :吸光度(O.D.)0.2 未満が望ましいです。バックグラウンドに影響する因子としては、ブロッキング試薬、捕捉用および検出用抗体の濃度、検出系、インキュベーション時間、希釈液、洗浄の操作などがあげられます。
標準曲線の値の最高値 :吸光度(O.D.)1.0 以上が望ましく、通常は1.0 ~ 3.0 です。標準曲線の値に影響する因子としては、捕捉用および検出用抗体の濃度(図1 の格子実験参照)、インキュベーション時間および温度、検出系に用いる基質などの濃度、抗体と抗原の親和性、pH、希釈液およびプレートリーダーの品質があげられます。
検出系 :アッセイの感度は、検出試薬の濃度または検出系を検討することで改善できることがあります。ただし、条件によってはバックグラウンドが高くなる場合があります。
血清および血漿試料の希釈 :血清および血漿試料は、マトリックス効果を排除するために、適切なバッファーを用いて2 倍以上希釈することが必要な場合があります。直線的な結果を得るために必要な試料の希釈系列を、あらかじめ検討し、決定して下さい。試料を希釈する際には、スタンダードに用いたのと同じ希釈液を使用します。また、希釈した試料を用いる場合は、希釈倍率をかけて値を算出します。
BSA :ウシ血清アルブミン(BSA)は、ブロッキングおよびキャリアータンパク質として用います。BSA は等級によってはバックグラウンドが高くなるため、ELISA グレードのBSA を選択する必要があります。 インキュベーション温度: 試料および検出用抗体のインキュベーションは、室温で行います。試料を冷蔵で一晩または37℃で1 時間インキュベートした場合は、感度が高くなることがありますが、同時にバックグラウンドも上昇することがあります。
インキュベーション時間 :室温でのインキュベーション時間を長くすることで、感度を上げることが可能です。ただし、標準曲線が平らになってしまって使用できなくなり、測定範囲が限定されてしまう可能性があることに留意して下さい。また、インキュベーション時間を長くすることでバックグラウンドも上昇することがあります。
干渉物質 :異好性抗体やリウマチ因子のような干渉物質の存在に注意することは重要です。これらの因子の制御方法については、“The Immunoassay Handbook Third Edition”(David Geoffrey Wild 編、Nature Publishing Group, 2001)をご参照下さい。
試薬の再構成および保存条件 :試薬を適切に作用させるためには、必ず各試薬の説明書に従って再構成および保存を行って下さい。
試料の準備および保存 :すべての試料が同一の安定性を有しているとは限らないため、取り扱いには注意が必要です。試料は調製後、ただちに一回使い切りの容量に分注して- 70℃で保管する必要があります。試料の種類によっては自動霜取機能のないフリーザーで-20℃に保管することも可能です。キャリアータンパク質を含んでいる試料が、最も望ましい状態です。凍結/融解の繰り返しは避けて下さい。
試料/スタンダードの量 :試料/スタンダードの量を増やす(例:100 μ l → 200 μ l)ことで、感度を上げることが可能です。
基質 :基質には様々な種類がありますが、中には十分な値を得るために長時間のインキュベーションが必要となる基質もあります。一般的には、基質に異常がなければ、インキュベーション時間を長くすることで感度を上げることが可能です。また、バックグラウンドが高くなりすぎないよう開発されたプレートであるかを確認して下さい。一般的なインキュベーション時間は、10 ~ 30 分です。基質の測定波長に対応したフィルターを使用して下さい。
シェーカーの使用 :室温でのシェーカー使用で感度を上げることができます。インキュベーション時間は検討して下さい。 洗浄 :ELISA プロトコルの洗浄操作(p.4「プレートの準備」 2. )をご参照下さい。不十分な洗浄は、高い分散係数やバックグラウンドをもたらし、不正確な値を得る原因になります。
感度: 感度は使用する抗体のペアによって様々です。感度に影響する因子としては、捕捉用および検出用抗体の濃度(図1 の格子実験参照)、インキュベーション時間および温度、抗体と抗原の親和性、試料/スタンダードの量、pH、希釈液および洗浄バッファーの組成があげられます。ただし、各抗体ペアが到達できる感度には限界があります。
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。


