知りたい!アレルギー・免疫に関連したこれからの炎症反応研究
島根大学 医学部 生化学講座(病態生化学分野)教授 浦野 健 先生
掲載日情報:2023/12/15 現在Webページ番号:70530
追加しました。

炎症反応は生体の防御反応の1つですが、病気の原因であったり、病気の増悪要因になったりします。炎症反応のメカニズムおよびその制御機構を研究することは、炎症に関与する経路や分子を包括的に理解することに繋がり、革新的な治療ターゲット、すなわち病気の新しい治療法を見つけるための重要な戦略となります。そのような経路や分子には、腫瘍壊死因子(TNF)-α、インターフェロン(IFN)-γ、インターロイキン(IL)-1β、IL-6やIL-18などがあります。
この総説では医薬品としてはまだ上市されていませんが、炎症性疾患の創薬ターゲットとしての可能性を持つIL-18を中心に、IL-1βとIL-18の活性化に共通するインフラマソーム経路、そしてIL-18を標的としたバイオ医薬品作製について、概説します。
インフラマソーム*1について
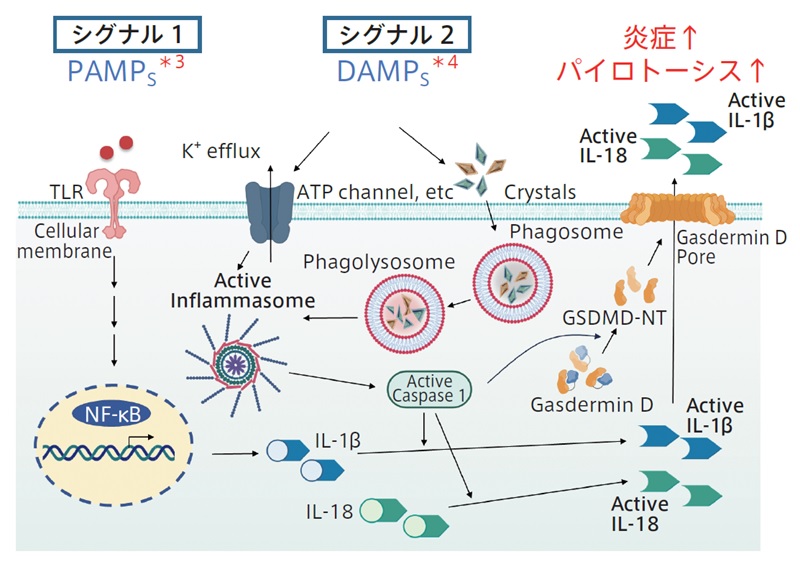
免疫は、細菌やウイルスなどの病原微生物の感染に対する重要な生体防御システムで、自然免疫系と獲得免疫系があります。自然免疫系は、病原微生物の侵入を察知し、炎症反応を引き起こすことで、防御する第一線で活躍するシステムです。このシステムはヒトのみならず、昆虫などの無脊椎動物や植物にも備えられています。その1つに、インフラマソームの形成と活性化を介するものがあります(図1)。このインフラマソームの複合体形成は、その構成メンバーであるタンパク質分解酵素カスパーゼ1の活性化を引き起こします。そして、カスパーゼ1依存的に炎症性サイトカインIL-1βとIL-18は活性化されます。また、カスパーゼ1依存的に活性化されたガスダーミンDは細胞膜に小孔を形成し、活性化されたIL-1βやIL-18はその小孔から放出されます。これらの活性化された炎症性サイトカインが炎症を惹起することになります。インフラマソームの活性化は、ガスダーミンD を介して炎症性プログラム細胞死であるパイロトーシスにも繋がります。インフラマソームは、アテローム性動脈硬化症、Ⅱ型糖尿病、アルツハイマー病、そして自己免疫疾患を含む多くの疾患に関与することが知られています。
IL-18について
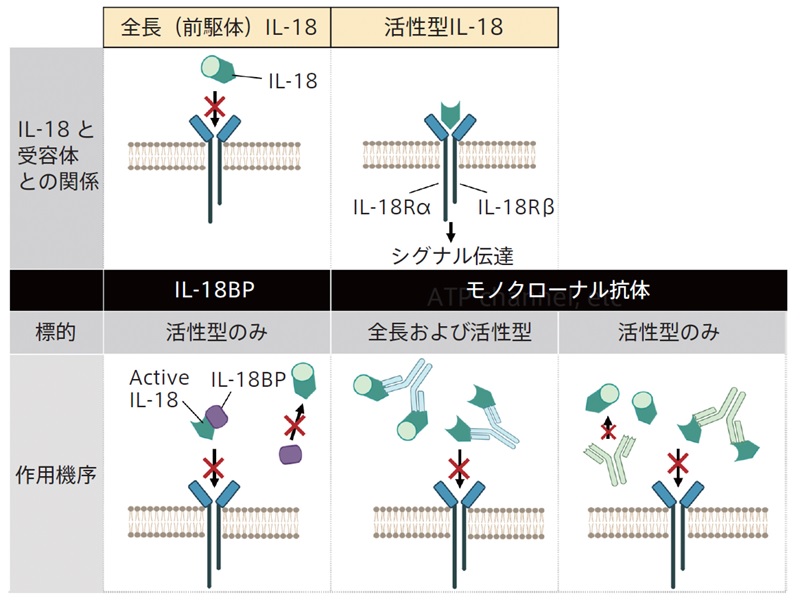
IL-18は、アミノ酸配列の相同性から、IL-1サイトカイン*2ファミリーに分類されます。IL-18は生物学的に不活性なIL-18前駆体(ヒトの場合は193アミノ酸、図2)として産生されます。受容体と結合するにはタンパク質分解酵素によるプロセッシングを必要とします(図1、図2)。IL-18にはシグナルペプチドがないのに、細胞外に分泌されるという謎はガスダーミンDの発見により解明されました(図1)。IL-18の供給源は、IL-18前駆体を構成的に発現するクッパー細胞であることが最初に証明されました。構成的に発現する細胞がある点は、IL-1βとは大きく異なる特徴となります。一方、IL-1βと同じように、前駆体の転写をシグナル1の刺激により誘導・増加させる樹状細胞やマクロファージのような細胞もあります。他にも、IL-18前駆体はケラチノサイト、腸上皮細胞、骨芽細胞など多種多様な細胞によって産生されることから、重要な病態生理学的役割を担っていることが示唆されます。
IL-18受容体(IL-18R)は、誘導性成分IL-18Rαと構成的に発現する成分IL-18Rβから構成されています。IL-18で刺激されると、IL-18RαはIL-18Rβと高親和性のヘテロ二量体複合体を形成し、細胞内にシグナルを伝達します。IL-18はIL-12の存在下では、T細胞、NK細胞、NKT細胞、B細胞、樹状細胞、マクロファージに作用してIFN-γを産生します。一方、IL-18はIL-2とともに(IL-12が存在しない状態で)、CD4+NKT細胞、NK細胞からIFN-γ以外のさまざまなサイトカインの産生も誘導します。また、IL-18とIL-3は、マスト細胞と好塩基球を刺激してIL-4とIL-13を産生させることができます。つまり、IL-18はそのサイトカイン環境に応じて多面的な作用を示します1。
IL-18を標的とした創薬戦略
成人発症スティル病、関節リウマチ、間質性肺炎、潰瘍性大腸炎やクローン病、多発性硬化症、糖尿病など多くの疾患で血清中IL-18が高値を示しており、IL-18タンパク質はこれらの疾患に対する有望な創薬標的として考えられています。その創薬戦略の1つは、IL-18の作用を特異的に阻害する内因性の可溶性因子であるIL-18結合タンパク質(IL-18BP)の応用であり、もう1つはモノクローナル抗体を用いた戦略です(図2)。IL-18BP投与により、実験的関節炎、大腸炎、間質性肺炎、Ⅰ型糖尿病などのマウスモデルでその病態を大幅に改善させています。
モノクローナル抗体では、2つの方法が考えられます。IL-18前駆体および活性型IL-18両方を認識する抗体を用いる方法と、活性型IL-18のみを標的とした抗体を用いる方法の2つです(図2)。クッパー細胞のように、IL-18前駆体を構成的に発現する細胞があり、炎症が惹起され傷害された細胞から大量のIL-18前駆体が放出されることで抗体が消費されてしまう可能性を避けるため、われわれは活性型IL-18のみを認識し、IL-18前駆体は認識しない抗体を作製することにしました2,3。実際、活性型IL-18のみを認識する抗体を用いて、間質性肺炎、潰瘍性大腸炎やクローン病、多発性硬化症などのマウスモデルでの病態改善を認めています。
バイオ医薬品*5としての抗体医薬開発
遺伝子組換え技術などを応用して作製される抗体医薬品についても解説します。抗体は、本来、生体防御に寄与するタンパク質で、免疫グロブリンとも呼ばれます。抗体医薬品は、疾患関連分子に特異的に結合する抗体を遺伝子組換え技術などを応用して作製し、医薬品としたものです。新型コロナウイルス感染症の治療として、感染回復期の患者血漿から精製された免疫グロブリン製剤も、広義には抗体医薬品に含まれます。20世紀半ばから、ヒト血
漿から精製された免疫グロブリン製剤が感染症治療などに用いられてきましたが、1975年に、ケラーとミルシュタインによりマウスモノクローナル抗体作製技術が確立され、疾患関連分子に対して特異的な結合能を持つ抗体を人工的に作製することが可能となりました。続いて、マウスモノクローナル抗体の臨床応用に際して問題となった免疫原性を低減し、血中濃度の維持をも可能にする技術(キメラ型抗体、ヒト化抗体、ヒト抗体の作製技術)が開発され、今日では、多くの抗体医薬品が臨床応用されています。
われわれの活性型IL-18のみを認識する抗体もヒト化を完了しています。新しい作製方法として、感染後の回復期の患者から中和抗体を産生するB細胞を取得して、その抗体遺伝子配列を基に医薬品として開発する方法も分子細胞生物学的手法が進歩したからこそなせる開発方法です(図3)。
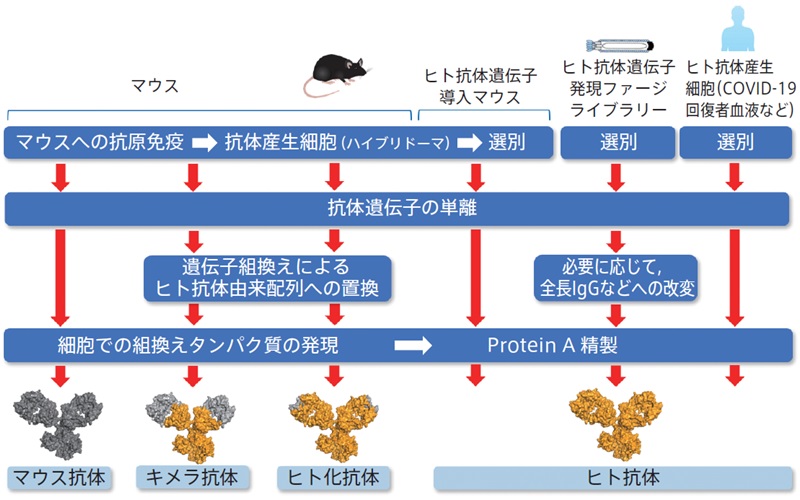
図3 抗体医薬開発の流れ
用語解説
*1 インフラマソーム(Inflammasome):細胞内で形成される複合体で、主な構成メンバーは細胞内受容体(NLRまたはALRファミリーメンバー)、アダプタータンパク質(ASC)およびタンパク質分解酵素カスパーゼ1前駆体です。構成タンパク質間のドメインを介した相互作用によって複合体化されます。複数の種類のインフラマソーム複合体が同定されており、最も特徴が明らかになっているのはNLRP3複合体です。NLRP3インフラマソームは、2段階のプロセスで活性化されます。1つ目は、NF-κBシグナル伝達です。PAMPs*3がToll様受容体(TLR;Toll-like receptor)に認識されNF-κBシグナルが伝達されることで、NLRP3およびIL-1β前駆体の発現が亢進します(プライミングステップ、シグナル1と呼ばれます)。2つ目は、カリウム流出や結晶など多数のシグナル(病原体、PAMPs/DAMPs*4、リソソームー損傷環境因子(尿酸、シリカなど)、内因性因子(アミロイド-β、コレステロール結晶など)およびミトコンドリアダメージなど)です。NLRP3が間接的に活性化され、複合体形成およびタンパク質分解酵素カスパーゼ1の活性化が起こります(シグナル2と呼ばれます)。インフラマソームは他にも、AIM2複合体(二本鎖DNAにより活性化)、NLRP1複合体(炭疽毒素により活性化)、NLRC4複合体(細菌性フラジェリンにより活性化)などがあります4, 5, 6。
*2 サイトカイン:炎症の重要な調節因子で細胞から分泌される分子量の比較的小さなタンパク質の総称で、炎症誘発性サイトカインと抗炎症性サイトカインに大別されます。IL-1βとIL-18は、代表的な炎症誘発性サイトカインです。
*3 PAMPs(pathogen-associated molecular patterns):宿主のセンサーである1回膜貫通型膜タンパク質のTLRなどが認識する、細菌やウイルス表面に存在する外因性の特徴的な構造の繰り返し(分子パターン)の総称です。
*4 DAMPs(damage-associated molecular patterns):本来は細胞内分子で、細胞傷害などに伴い細胞外に放出され炎症反応を引き起こす自己由来の分子パターンの総称です。
*4 バイオ医薬品:生物学的製剤とも言われます。化学合成で作られた薬剤ではなく、細胞を用いて遺伝子組換え技術により作られたタンパク質が有効成分となっている薬剤のことです。われわれの体にある抗体や受容体、あるいは細胞表面の分子などと同じ構造をもっており、関節リウマチや炎症性腸炎など多くの病気の治療に用いられています。主に注射剤で、錠剤はありません。製造過程は化学合成薬に比べて複雑で、手間や費用がかかります。
参考文献
- Yasuda, K., et al., Int. J. Mol. Sci., 20(3),649(2019).
- Nariai, Y., et al., Arch. Biochem. Biophys., 663, 71~82(2019).
- Uchida, Y., et al., Arch. Biochem. Biophys., 727, 109322(2022).
- Guo, H., et al., Nat. Med., 21(7), 677~687(2015).
- Mangan, S. J. M., et al., Nat. Rev. Drug Discov., 17(8), 588~606(2018).
- Swanson, V. K., et al., Nat. Rev. Immunol., 19(8), 477~489(2019)
追加しました。
お問い合わせ先
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。