HOME
>
試薬
>
創薬研究
>
探索研究
>
スクリーニング/探索用商品
>
ATCC® Organoid Culture Guide
HOME
>
試薬
>
細胞培養
>
ATCC商品
>
ATCC® Organoid Culture Guide
オルガノイドの培養方法(解凍・継代・維持・凍結保存など)をご紹介します ATCC® Organoid Culture Guide
掲載日情報:2023/08/29 現在Webページ番号:70289
正常/疾患患者由来組織に適用できる、オルガノイドのルーチン処理に関する標準的な操作をご紹介します。基本的な操作方法は、従来の二次元培養や初代細胞の培養を経験した研究者には馴染み深いものです。しかし、オルガノイドの培養は下記に示すように通常の細胞培養よりも考慮すべき点が多く、細かな条件検討と培養試薬・器具の準備が必要です。
- 市販されていない複雑な組成の組織特異的培地の調製
- 正確な細胞数の計測
- 操作の難しさ
- 化学的に定義されていない成分はバッチ間でばらつきがあり、しかも複数使用する場合がある
- 三次元培養では、独自の操作方法が求められる様々な細胞外マトリクスを使用
本記事では、下記のように基本プロトコル1~3に従ってオルガノイドの培養方法をご紹介します。
- 基本プロトコル1:凍結保存されたオルガノイドの解凍と培養
- 基本プロトコル2:オルガノイドの維持と拡大
- 基本プロトコル3:オルガノイドを凍結保存
※ 紹介するプロトコルは、標準的なバイアルで凍結保存されたオルガノイドを想定したものです。特定のモデルや組織、疾患などは、供給元(バイオバンクなど)から提供されたモデル固有の詳細情報を参照し、適宜培養条件やプロトコルを調整して下さい。基本プロトコル中にも重要な手順について示しています。
※ そのほか、オルガノイド培養の背景や歴史、オルガノイド培養における重要なポイント、トラブルシューティング、オルガノイド培養に必要な作業時間については、本ページの末尾にある解説をご覧下さい。
※ ATCC®のHCMIの次世代がんモデル紹介ページはこちらをご覧下さい。各種HCMI製品のほか、ATCC®の各種オルガノイドの培養に最適化されたOrganoid Growth Kitをご紹介しています。
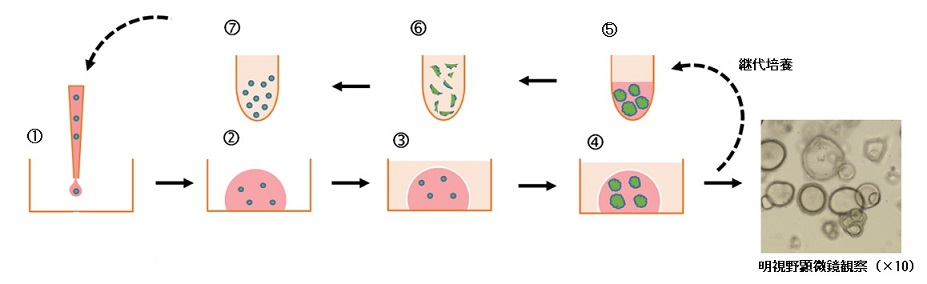
図1:オルガノイドの三次元培養(ドーム法)のワークフロー
各細胞またはオルガノイドフラグメントを、液体の細胞外マトリックス(ECM、Ectra-cellular matrix)内に包埋し、温めた組織培養のプラスチック容器の表面に小さな液滴で分注する。ECMは、37℃のインキュベーション後に固化してゲルになり、培地で覆うことができる。オルガノイドは、ドーム内で三次元構造として成長する。
追加しました。
- 培養を始める前に
- 基本プロトコル1:凍結保存したオルガノイドの解凍
- 基本プロトコル2:オルガノイドの培養と増殖
- 基本プロトコル3:オルガノイドの凍結保存
- 温水ボトル(フラスコ)の準備方法
- オルガノイド培養の背景および歴史
- オルガノイド培養における重要なポイント
- トラブルシューティング
- 予想されるオルガノイドの状態・形態
- オルガノイド培養に必要な作業時間
- その他関連ウェブページ
- 引用文献
培養を始める前に
- プロトコル全体を確認して下さい。すべてのプロトコルは、無菌培養条件下で無菌の器具、細胞培養グレードの試薬を使用し、適切な防護具を着用して操作する必要があります。実験室での作業中は、常に品質保証管理システム(Good Laboratory Practices; GLP)に従って下さい。
- 安全に関する重要な情報については、使用前にすべての試薬の安全データシート(SDS)を参照して下さい。
- オルガノイドの凍結バイアルに添付される試験成績書またはそのほかの書類を参照して、試料が汚染されていないことを確認して下さい。すべてのヒト由来試料は、潜在的にバイオハザードの可能性があるものとして扱い、適切なバイオセーフティ条件下で取り扱って下さい。詳細は、所属機関の安全管理室へ確認して下さい。
追加しました。
基本プロトコル1:凍結保存したオルガノイドの解凍
一般的な細胞と同様、クライオバイアルを液体窒素から取り出し速やかに解凍します。細胞懸濁液を洗浄して凍結保存試薬を除去し、細胞ペレットを形成させます。ペレットを液体ECMに再懸濁し、プラスチック製組織培養器材の上に小さな液滴として分注します。37℃で短時間インキュベーション後、凝固してゲルとなった液滴に温かい液体培地で覆います。オルガノイドは、このドーム状ゲル内で成長および拡張します。
必要な試薬類
解凍前の準備
- オルガノイドモデル用の培地を準備します。モデル固有の情報を参照し、適切な培地を準備して下さい。同じオルガノイド組織/タイプでも培地組成が異なる場合があり、モデルの表現型が変化する可能性があります。モデル固有の情報が得られない場合は、表1の培地組成例をご覧下さい。
- 15 mlコニカルチューブへ基礎培地10 mlを移し、室温に戻します。
- オルガノイドを播種するウェルごとに、2 mlの完全培地を添加して室温に戻します。1×106 cellsの場合、6ウェルプレートの2つのウェルに播種できる量となります。可能であれば、オルガノイドモデル固有の推奨される播種条件の情報を参照して下さい。細胞数が分からない場合は、4 mlの完全培地を室温に戻し、6ウェルプレートの2つのウェルに播種して下さい。
- ECMを解凍します。ストック容器や分注済みのECMは、4℃で解凍して下さい。冷蔵庫内の温度変化の影響を減らすため、バイアルは氷上か冷却ラックに置いて下さい。5 ml以上のECMを使用する場合は、一晩かけて解凍する必要があります。少量(1 ml以下)の場合、氷上で数時間かけて解凍します。推奨のECMは、オルガノイドモデル固有の情報を参照し、提供された準備と取り扱いの指示に従って下さい。オルガノイドモデルによっては、ECMを所定の最終濃度へ希釈する必要があります。ECMを希釈する場合は、特に指定がない限り完全培地を使用して下さい。オルガノイドモデル固有の情報がない場合、本プロトコルではCell Basement Membrane(ATCC® ACS-3035TM)を終濃度10~18 mg/mlで使用します。必要量のみを解凍し、解凍後は氷上に静置して下さい。一度解凍したECMは再凍結しないで下さい。解凍したECMは、4℃で最長7日間保存できます。ECMを希釈した場合は、保管せずにすぐに使用して下さい。
- 播種する培養容器を、37℃インキュベーターで60分以上温めます(大型の培養容器はさらに時間がかかる場合があります)。
- オルガノイドの凍結保存バイアルを液体窒素貯蔵庫から取り出し、37℃のウォーターバスで直ちに解凍します。キャップを持って、ウォーターバス内でバイアルを静かに旋回させます(バイアルを完全に浸さない)。少量の氷が残る程度まで解凍します。オルガノイドの生存率と回復率を損なわないよう、1~2分程度で解凍して下さい。
- バイアルを70%エタノールで除菌し、キャビネットに移します。
- P1000ピペッターで、クライオバイアル内の溶液を手順2で調製した10 ml基礎培地入りコニカルチューブに滴下します。
- バイアル内に残っている細胞を回収するため、クライオバイアルに1 mlの基礎培地を添加してピペッティングし、前述のバイアルに添加します。
- 懸濁液を遠心分離してペレットにします。モデル固有の情報を参照し、推奨される速度と時間で遠心分離して下さい。オルガノイドモデル固有の情報がない場合、室温で500×gで5分間遠心分離します。
- ペレットを崩さないよう丁寧に上清を吸引除去し、チューブを室温に保ちます。遠心分離後、ぼんやりとした液状のECM層が存在する場合があります。倒立顕微鏡で観察して、ECM層にオルガノイドがあまり含まれていない場合は、ECM層を吸引して廃棄します。オルガノイドがECM層に残っている場合は、さらに洗浄を行えます。10 mlの冷やした基礎培地を加え、手順10と11を繰り返します。
- 冷やした液体ECMでペレットを再懸濁します。P200ピペッターを使用して、20~30回(ペレットが完全に再懸濁されるまで)ピペッティングします。バイアルあたりの細胞数やその他の播種手順についてはロットごとの情報を参照して下さい。通常、解凍後のオルガノイドは、6ウェルプレートに1ウェルあたり100 μlのECM、細胞密度2.5~5×105 cellsで播種します。細胞数が分からない場合は、200 μlのECMでペレットを再懸濁し、6ウェルプレートの2つのウェルに100μlずつ播種します。ピペッティング中、ECMに気泡が入らないようにして下さい。早期のECM重合を防ぐために、チューブと内容物を温めないように、すばやく作業します。すぐ播種できない場合は、ECMとオルガノイドの懸濁液を含むチューブは、氷上に静置します。
- 温めておいた培養容器をインキュベーターから取り出し、キャビネットに入れます。以降は、容器が温かいうちに迅速に作業して下さい。より大きな容器に播種したり、重合しにくいECMを使用する場合は、キャビネット内に温水ボトルを用意して(温水ボトルの準備方法参照)、その上に容器を置いて温度を維持します。
- P200ピペッターでオルガノイド懸濁液100 μlを吸引し、温めた6ウェルプレートへ10~15 μlずつ液滴として分注します。播種する各ウェルに対して繰り返します。播種の直前に、ピペッティングを繰り返して、均一な懸濁液を維持して下さい。大量の液滴を分注する場合は、気泡が入らないよう注意しながら、定期的にピペッティングする必要があります。素早く、1ウェルあたり8~10つの液滴を分配していきます。液滴が互いに接触したり、ウェルの壁面に触れないようにして下さい。液滴は隆起したドームを形成します。
- 播種後、すぐにプレートに蓋をして慎重に裏返します。裏返すとドームが簡単に形成され、オルガノイドがECM中に沈み、プラスチック表面との接触を最小限に抑えることができます。
- 裏返したプレートを37℃のインキュベーターに移します。プレートを15~30分間そのままにして、ECMを重合させます。
- プレートをキャビネットに戻し、通常の向きに戻します。ドームが形成されない場合は、トラブルシューティングを参照して下さい。
- ドームを壊さないように、室温で温めた完全培地を播種したウェルに2 mlずつ慎重に添加します。
- オプション操作:ROCK Inhibitor Y-27632(例: ATCC® ACS-3030TM)の10 mMストック溶液2 μl(完全増殖培地1 mlあたり1 μl)を増殖培地に添加します。Y-27632の必要性は、オルガノイドモデル固有の情報を参照して下さい。オルガノイドモデルによっては、ROCK inhibitorを解凍後に添加し、回復率を改善することができます。オルガノイドモデル固有の情報がない場合は、Y-27632を培地に終濃度10 μMとなるよう添加します。
- プレートをインキュベーターに戻し、3日間培養します。明視野顕微鏡で成長を観察します。オルガノイドは通常、解凍後2~7日で確認できます。
- 培地交換は、ドームを壊さないようウェルから培地を完全に吸引し、室温に温めた2 mlの完全培地を加えます。必要な場合を除き、完全培地にはY-27632を添加しないで下さい。ドームはプレート表面から剥がれることがありますが(考えられる原因は、トラブルシューティングを参照)、まだ使用できるオルガノイドが含まれている可能性があるため、可能であれば廃棄しないで下さい。培地交換する際は、浮遊しているドームを吸引しないようにして下さい。
- 2~3日ごとに完全培地で培地交換を行います。
表1:がんオルガノイド用培地の組成例(終濃度)
| コンポーネント | 基礎的な組成 | 食道がん | 結腸がん | 膵臓がん | 乳がん |
|---|---|---|---|---|---|
| Advanced DMEM:F12 | NA | NA | NA | NA | NA |
| HEPES | 1× | 10 mM | 10 mM | 10 mM | 10 mM |
| L-Glutamine | 1× | 1× | 1× | 1× | 1× |
| Noggin | Not included | 100 ng/ml | 100 ng/ml | 100 ng/ml | 100 ng/ml |
| FGF-10 | Not included | 100 ng/ml | Not included | 100 ng/ml | 20 ng/ml |
| FGF-7 | Not included | Not included | Not included | Not included | 5 ng/ml |
| Nicotinamide | Not included | 10 mM | 10 mM | 10 mM | 10 mM |
| N-Acetyl cysteine | Not included | 1 mM | 1 mM | 1.25 mM | 1.25 mM |
| B-27 supplement | Not included | 1× | 1× | 1× | 1× |
| EGF | Not included | 50 ng/ml | 50 ng/ml | 50 ng/ml | 5 ng/ml |
| Heregulin-beta | Not included | Not included | Not included | Not included | 5 nM |
| SB202190 | Not included | 10 μM | 10 μM | Not included | 1.2 μM |
| A83-01 | Not included | 500 nM | 500 nM | 500 nM | 500 nM |
| Gastrin | Not included | Not included | Not included | 10 nM | Not included |
| Y-27632 | Not included | Not included | Not included | Not included | 5 μM |
| Wnt-3A CM*1 | Not included | 0.5 | Not included | 0.5 | Not included |
| R-spondin1 CM*1 | Not included | 0.2 | 0.2 | 0.1 | 0.1 |
*1 CM(Conditioned medium;コンディション培地)の詳細はこちらをご覧下さい。
※ 既に確立されたオルガノイドモデル(市販の供給元から提供されたものなど)を培養する場合、抗生物質は含めないで下さい。存在しうる低レベルのコンタミネーションの問題を覆い隠してしまう恐れがあります。細胞がマイコプラズマに汚染されていないかを定期的に検査し、すべての試薬と培地が無菌状態であることを確認して下さい。
※ 基礎培地は完全培地ではありません。オルガノイドの洗浄や簡易的な保管に使用して下さい。
※ ATCC®の各種オルガノイドの培養に最適化されたOrganoid Growth Kitはこちらをご覧下さい。
解凍
追加しました。
基本プロトコル2:オルガノイドの培養と増殖
オルガノイドは、機械的(物理的)および酵素的手法を組み合わせて分散後、継代します。分散させたオルガノイドを洗浄し、新鮮なECM中で再懸濁します。一部のオルガノイドモデルは単一細胞レベルまで分散させることができますが、それ以外のモデルは回復が損なわれないよう小さな細胞塊にする必要があります。また、接着性の強いオルガノイドモデルもあり、ピペットチップやセロロジカルピペット、チューブの内側に付着するなど収量が低下する原因となります。基礎培地でこれらプラスチック器材をあらかじめ湿らせておくことで、この付着を防ぐことができます。通常、オルガノイドの継代スケジュールはサイズ(例:大きくなってドーム内で互いに接触するようになったタイミング)または分化指標(例:オルガノイド内にデブリが蓄積したタイミング)によって決められます。図2では、培養の各段階におけるオルガノイドモデルの形態例を示しています。推奨の継代頻度は、モデルごとの情報を参照して下さい。モデルによって、7日ごとに継代する場合や、10~14日間培養して増殖してから継代が必要な場合もあります。ルーチン培養の維持や増殖には、6ウェルプレートまたは100 mmディッシュが使われます。これよりも小さな培養容器では、オルガノイドの回収と継代が非常に難しく時間もかかります(全体的な手順は同じ)。
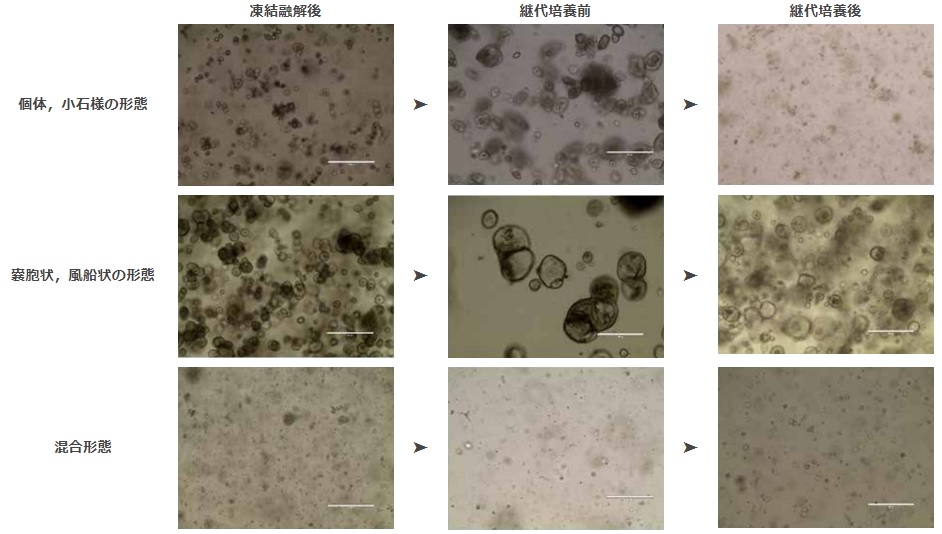
図2:解凍後/継代準備が整った状態/継代後の各段階でのオルガノイドモデル形態のイメージ例
必要な試薬類
準備
- 完全培地は室温に温め、基礎培地は4℃(氷上)に保ちます。
- ECMを4℃で解凍し、必要に応じて希釈します(モデル別の情報を参照して下さい)。解凍後は氷上に静置して下さい。
- 継代に用いる培養容器を37℃のインキュベーターに入れ、少なくとも60分間インキュベーションします。
- ドームを壊さないよう、培養容器から培地を吸引除去します。吸引の際は、浮遊しているドームを吸わないように避けて下さい。
- セルリフターで、プレート表面から容器の底または角に付着したドームを掻き取ります。ドームをできるだけ壊さないようにして下さい。ドームを無傷の状態で洗浄用チューブに移すことで、オルガノイドの組織培養プラスチックへの付着を最小限に抑えることができます。セルリフターは小型、使い捨て、滅菌済みなので、ディッシュでの作業に適しています。セルリフターがない場合は、小型のセルスクレーパー(Corning社#3010など)またはP1000ピペットチップの先端を使用して、プレート表面からドームをこすり取ることもできます。
- 分離したドームを含む各ウェルに少量の基礎培地(例:6ウェルプレートの場合は0.25 ml/well、10 cm2 ディッシュの場合は最大1 ml/dish)を加えると、ドームのピペッティングが容易になり、ピペットチップ表面への付着を防げるため、その後の移し替えが容易になります。
- 冷やした基礎培地であらかじめ湿らせたP1000ピペットチップまたは5 mlのセロロジカルピペットを使用し、回収したドーム塊と培地を空のコニカルチューブに移します。ECM量ごとの推奨チューブサイズは、表2をご覧下さい。
使用直前にピペットチップやピペットを濡らした後、内部をコーティングするのに十分な基礎培地を分注します。少量の基礎培地と、ピペットチップを基礎培地であらかじめ湿らせておくことで、ドームのピペットチップ表面への付着を抑制します。
6ウェルプレート1枚では、1度に最大6ウェル分のECM(総ECM量600~1,200 μl)をまとめて回収することが可能です。より大きな培養容器の場合は、ECMの除去を簡単に行うために、まとめず個別に処理します。液量が多いほどECM除去の洗浄ステップも多くなり、収量が減少する可能性があります。 - 冷やした基礎培地であらかじめ湿らせたP1000ピペットチップを使用して、オルガノイド・ECM・培地の混合物を20~30回ピペッティングして、ドームを完全に破壊します。このステップでドームを十分に機械的に破壊し、オルガノイドをECMから遊離させることが重要です。
- 冷やした基礎培地でチューブを最大量まで満たします。オルガノイドを冷やした基礎培地で洗浄するとECMが液状になり、次のステップで簡単に除去できます。
- 懸濁液を遠心分離してペレットにします。モデル固有の情報を参照し、推奨される速度と時間で遠心分離して下さい。モデル固有の情報がない場合は、500×gで5分間、できれば4℃で遠心分離します。
- ペレットを吸引しないよう、慎重に上清を除去します。遠心分離後に、濁ったECMの液層が存在する場合があります。ECMにオルガノイドが含まれていなければ、吸引して廃棄します。オルガノイドがECM液層内に残っている場合は、操作9~11を繰り返しさらに洗浄します。
- 機械的処理のみの場合:P1000ピペッターで、ペレットを1~2 mlの基礎培地に再懸濁します。チップをチューブの底に押し付けながら20~30回ピペッティングして、オルガノイドをより小さな細胞塊にします。懸濁液がコニカルチューブに入ったままの状態で倒立顕微鏡で観察し、オルガノイドが細胞塊になるまで操作を続けます。その後、操作18に進みます。オルガノイドの機械的処理が困難な場合のヒントについては、トラブルシューティングを参照して下さい。
- 機械的処理と酵素を併用する場合:P1000ピペッターで、ペレットを1~2 mlの分散用バッファー(室温)に再懸濁します。チップをチューブの底に軽く押し付けながら、20~30回ピペッティングします。懸濁液をコニカルチューブに入れたまま、倒立顕微鏡で分散状態を観察し、オルガノイドが細胞塊になるまで機械的処理を続けます。その後、手順14の酵素処理に進みます。推奨の分散バッファーは、モデル別の情報を参照して下さい。モデル別の情報がない場合は、Trypsin-EDTA for Primary Cells またはTrypLE Expressをお勧めします。
- 酵素処理のみの場合:表2で推奨されている量の分散バッファー(室温)をオルガノイドペレットに加え、最大速度で短時間ボルテックスして再懸濁します。チューブを37℃のウォーターバスに3~15分間置き、定期的にボルテックスします。大量の分散バッファー(10 ml以上)を使用する場合、37℃に達するまでに10分以上かかる場合があります。オルガノイドを再懸濁する直前に、必要量の分散バッファーを37℃のウォーターバスで5~10分間温めておくと、より迅速に解離させることができます。
- 2~3分ごとに倒立顕微鏡で破砕状態を観察し、懸濁液中のオルガノイドが目的の状態(単一細胞または小さな細胞塊)になったら処理を停止します。オルガノイドモデルによっては、単一細胞まで分散させるとオルガノイド形成能力が損なわれる場合があります。必要に応じて、モデル別の情報を参照して下さい。モデル別の情報がない場合は、オルガノイドモデルが回復することを実験的に確認できるまでは、単一細胞まで分散させないで下さい。
- オプション:細胞数を計測する場合は、懸濁液から少量を採取します。完全に分散していない場合は、分散バッファーを添加した状態で37℃でインキュベート(必要に応じて定期的にボルテックス)し、単一細胞に分散させます。継代時には完全に解離させないモデルの場合、6ウェルプレートなら1ウェル分を採取し、単一細胞懸濁液に解離させて細胞数を計測します。ここで計測した細胞数を元に、同時に培養している他のプレート/容器の細胞数を推定します。分散バッファーで長時間インキュベーション(15分以上)することによる効果は、モデルによって異なります。
- 分散を停止するには、等量以上の基本培地で分散バッファーを希釈し、チューブの最大量まで加えます。推奨量は、表2をご覧下さい。
- 懸濁液を遠心分離してペレットにします。モデル別の情報を参照し、推奨される速度と時間で遠心分離して下さい。オルガノイドモデルごとの情報がない場合は、500×gで5分間(可能なら4℃で)遠心分離します。
- ペレットを崩さないように、慎重に上清を吸引して廃棄します。
- ペレットを少量の基礎培地に再懸濁し、単一のチューブにまとめて(必要に応じて複数のチューブから回収したオルガノイドをまとめることもできます)、操作18と19を繰り返します。
- 細胞ペレットをECMに再懸濁します。一般的なECM量は、表3をご覧下さい。P1000ピペッターを使用して、20~30回にピペッティングして混合、または完全に再懸濁します。気泡が入らないようご注意下さい。推奨の播種密度は、HCMIモデルごとの情報を参照して下さい。モデルごとの情報がない場合は、1:4の割合で分割(例:6ウェルプレートの1ウェルを継代する場合、ペレットを400 μlのECMに再懸濁し、新しい6ウェルプレートの4つのウェルに100 μlずつ播種)するか、ECM 100 μlあたり5×105 cellsの生細胞の割合で再懸濁します。ECMが早く重合するのを防ぐため、迅速に作業し、ECMを低温に保ちながら時々ピペッティングで混合して均一な懸濁液の状態にします。
- インキュベーターから培養容器を取り出し、キャビネットに移します。培養容器が温かい状態であればドーム形成が促進されるため、迅速に操作します。必要に応じて、37℃に保温した水を満水に入れた大型容器をキャビネット内に入れ、その上に培養容器を置きます(温水ボトルの準備方法をご覧下さい)。
- P200ピペッターを使用し、適量のECM/オルガノイド懸濁液を吸引し、10~15 μlの液滴として培養容器表面に均一に滴下します。6ウェルプレートに播種する場合は、100 μlを吸引して1ウェルに播種します。より大きな容器(例:10 cm2 ディッシュ)に播種する場合は、一度に200 μlを吸引して下さい。推奨のECM量と容器サイズについては、表4をご覧下さい。播種の直前にピペッティングで溶液を均一にします。大量のECM/懸濁液を播種する場合、定期的に混合する必要があります。気泡を混入させないようにして下さい。液滴は互いに接触したり、ウェルの壁に触れないようにして下さい。迅速に作業して下さい。液滴は分離したままで、盛り上がったドーム状にしておきます。
- すぐに容器に蓋をして、ドームを壊さないように慎重に裏返しにして下さい。プレートを反転すると、ドームが簡単に形成され、解離したオルガノイドが重合する前にドーム底に沈む可能性が低くなります。
- 容器は逆さのまま、37℃の細胞培養インキュベーターに移します。ECMを重合させるため、容器を15~30分静置します。
- 容器をキャビネットに移し、通常の向きに戻します。ドームが形成されない場合は、トラブルシューティングをご覧下さい。
- ドームを崩さないよう注意して、室温の完全培地を添加します。培養容器ごとの推奨培地量は表4をご覧下さい。継代時にY-27632の添加が推奨されるかどうかは、HCMIモデルに付属の情報をご覧下さい。モデルごとの情報がない場合には、継代時にY-27632は添加しないで下さい。
- プレートをインキュベーターに戻します。
- 2~3日ごとに培地交換を行い、必要に応じて継代を行います(モデルによっては7~14日ごと)。
ECMの除去と洗浄
オルガノイド継代の最初のステップは、ドーム状オルガノイドを機械的に壊して基礎培地で洗浄し、可能な限り多くのECMを除去することです。一部のECMは、洗浄溶液を冷やすと液状に戻りやすく、ECMを簡単に除去できます。1つのチューブ内で処理するドームの数が多いと、ECMの除去が難しく、通常よりも多くの洗浄ステップが必要です。
表2:分散バッファーや希釈バッファーの液量
| 培養器材 | ECM量 | コニカルチューブサイズ | 洗浄液量 | 分散バッファーの液量 | 希釈液量 |
|---|---|---|---|---|---|
| 6 well plate (1 well) | 100~200 μl | 15 ml | ≦15 ml | 2~3 ml | ≦10 ml |
| 6 well plate (2 wells) | 200~400 μl | 15 ml | ≦15 ml | 4~6 ml | ≦10 ml |
| 6 well plate (3 wells) | 300~600 μl | 50 ml | ≦20 ml | 6~9 ml | ≦20 ml |
| 6 well plate (4 wells) | 400~800 μl | 50 ml | ≦50 ml | 8~10 ml | ≦50 ml |
| 6 well plate (5 wells) | 500~1,000 μl | 50 ml | ≦50 ml | 10~11 ml | ≦50 ml |
| 6 well plate (6 wells) | 600~1,200 μl | 50 ml | ≦50 ml | 11~15 ml | ≦50 ml |
| 10 cm2ディッシュ | 600~1,200 μl | 50 ml | ≦50 ml | 11~15 ml | ≦50 ml |
オルガノイドの分散と洗浄
ECM除去後に、オルガノイドは単一の細胞または細胞塊に分散させます。モデルによっては機械的破壊または酵素的解離のみで十分な場合もあれば、両方の操作が必要になる場合もあります。分散しやすさは、モデルによって大きく異なる場合があります。分散条件についてはモデル別の情報を参照し、推奨の方法に応じて手順12、13、14から始めます。
表3:容器サイズごとの推奨ECM量
| 培養容器 | 表面積(cm2) | ECM量*2 | ドームの数 |
|---|---|---|---|
| 48ウェルプレート (1 well) | 0.95 | 10 μl | 1 |
| 24ウェルプレート (1 well) | 1.9 | 20 μl | 1~2 |
| 12ウェルプレート (1 well) | 3.8 | 40 μl | 3~4 |
| 6ウェルプレート (1 well) | 9.5 | 100 μl | 8~10 |
| 6ウェルプレート (entire plate) | 57 | 600 μl | 48~60 |
| 10 cm2 ディッシュ | 55 | 600 μl | 48~60 |
*2ECMは10 μlの液滴として分注して下さい。
オルガノイドの播種
分散後、単一細胞または細胞塊を新鮮なECMに再懸濁し、3Dドームとして培養容器に戻します。操作スピードと温度は、オルガノイドとECMの取り扱いにおいて重要なパラメーターです。通常、複数の小さな培養容器に播種する方が、大きな容器に播種するよりも操作が簡単です。
すべてのセロロジカルピペットやピペットチップは、オルガノイドの付着を防止するため、基礎培地であらかじめ濡らしておきます。
表4:容器サイズごとの推奨増殖培地量
| 培養容器 | 培地量 |
|---|---|
| 48ウェルプレート (1 well) | 0.25~0.3 ml |
| 24ウェルプレート (1 well) | 0.5~0.75 ml |
| 12ウェルプレート (1 well) | 1~1.5 ml |
| 6ウェルプレート (per well) | 2~2.5 ml |
| 6ウェルプレート (entire plate) | 12~15 ml |
| 10 cm2 ディッシュ | 12~15 ml |
追加しました。
基本プロトコル3:オルガノイドの凍結保存
オルガノイドは通常、継代するタイミングで凍結保存します。凍結保存する際は、無傷のオルガノイド、細胞塊、または分散状態の細胞が含まれます。凍結保存の条件については、モデル別の情報をご覧下さい。無傷のオルガノイドや細胞塊の場合、正確な細胞数を計測するために細胞を分散させることはできません。そのため、例えば同時並行でオルガノイドを培養していた場合、そのうちの一つ(6ウェルプレートの数ウェル分など)からオルガノイドを回収、分散、細胞数を計測し、並行して培養した条件の細胞数を予測することが可能です。細胞数を計測しない場合は、1バイアルあたり6ウェルプレートの1~2ウェル分を500 μlの凍結保存用培地で保存します。
必要な試薬類
準備
- オプション操作:オルガノイドを培養している6ウェルプレートの中から1~3ウェルについて、基本プロトコル2の操作4~11および13~16を行います。これらは、より大きな容器サイズ(例えば、10 cm2 ディッシュ)で並行して成長したオルガノイドの細胞数を推定するために使用されます。複数のウェルから回収する場合、オルガノイドはまとめずに別々に回収し、それぞれ細胞数を計測、平均して、1ウェル分のオルガノイド細胞数とします。例えば、6ウェルプレートの3つのウェル(各100 μl ECM)からの個々の総生細胞数を計測し、1.0×106、1.5×106、0.75×106という結果になった場合、10 cm2ディッシュの推定生細胞(600 μl ECM)は6.5×106です。細胞数が想定よりも著しく少ない場合、基本プロトコル2に従ってオルガノイドを継代および増殖させる必要があります。細胞数が想定よりわずかに少なく、継代は必要でない場合(内腔に顕著な細胞片の蓄積やその他の分化の兆候がない場合)、オルガノイドをさらに1~2日間培養し、再度細胞数を計測して下さい。
- 凍結保存するオルガノイド1バイアルあたり0.5 mlの凍結保存用培地を解凍し、氷上に置きます。推奨の凍結保存用培地は、各モデルの説明書をご覧下さい。モデル固有の情報がない場合、本プロトコルではStem Cell Freezing Media(ATCC®)およびRecovery Cell Freezing Medium(Thermo Fisher Scientific社)を使用します。
- 基礎培地を氷上に置きます。
- 凍結バイアルにラベルを付け、キャビネットに移します。
- 基本プロトコル2の手順4~11に従って、ドームからオルガノイドを回収しECMを除去して下さい。酵素処理のステップは、単一細胞からの回収が可能なモデルのみ行って下さい。必要に応じて、基本プロトコル2の手順17までを参考にして下さい。
- 複数の容器から回収する場合は、1つのコニカルチューブに集め、モデル推奨の遠心分離条件に従ってペレット化します。モデル固有の情報がない場合は、4℃、500×gで5分間遠心分離して下さい。
- 2×106 cellsあたり(上記で計算した推定細胞数)、または100~200 μlの採取ドーム(6ウェルプレートの1~2ウェル)あたり0.5 mlの凍結保存用培地でペレットを再懸濁します。
- 10 mlセロロジカルピペットで、オルガノイドと凍結保存用培地の懸濁液をラベル付き凍結バイアルに0.5 mlずつ移します。ピペッティングして、均一な懸濁液にします。必要に応じて、セロロジカルピペットを凍結保存用培地であらかじめ湿らせて、細胞の付着を防いで下さい。
- バイアルを凍結保存容器に入れます。オルガノイドを最適な状態で回復させるためには、CoolCell LX(ATCC® ACS-6000TM)などの凍結保存容器を使用して、1℃/分の速度で凍結保存する必要があります。
- バイアルを液体窒素の気相部に移し、長期保存します。
凍結保存用培地を用いたオルガノイドの保存
追加しました。
温水ボトル(フラスコ)の準備方法
大きなフラスコに滅菌水を満たし、インキュベーター内で37℃に温めます。これをオルガノイドの播種時に表面を温かく保つために使用することができます。キャビネット内のフラスコの上に、マルチウェルプレートまたはディッシュを置いて作業します。
- T225フラスコをキャビネット内に垂直に置きます。
- キャップを外し、滅菌水(1 L)で完全に満たします。
- フラスコの蓋を締めます。可能であれば、プラグシールキャップを使用して下さい。
- パラフィルムをキャップにしっかりと巻き付けます。
- フラスコを水平に傾けます。気泡が生じないようにして下さい。
- 37℃のインキュベーターに移します。フラスコは、常時インキュベーターに保管するか、使用する6時間前にインキュベーターに入れます。
追加しました。
オルガノイド培養の背景および歴史
オルガノイドという用語は、三次元器官培養の多様性を含んだ意味で使われてきました。しかし、現在では初代組織、人工多能性幹細胞(iPSC)、または胚由来の幹細胞(ESC)を用いた培養のアプローチ方法をより具体的に説明するために使用されています。幹細胞は、ECM中で成長し、in vivo組織様の特徴と機能を示す明確な構造を持つ複雑な微小組織に自己組織化します(Shamir & Ewald, 2014)。
2009年にこの培養系が初めて提示された時は、幹細胞ニッチ調節因子(Wnt-3A、Noggin、R-spondin1、EGF)を含む培地と三次元培養を利用して、マウス小腸のオルガノイドが作製されました(Sato, et al., 2011)。この「ミニ腸」オルガノイドは、明確な絨毛–陰窩構造を示し、ムチンを分泌する杯細胞など腸上皮細胞に特異的な発現が認められました。この培養系は後に、ヒトの小腸、結腸、食道、胃、膵臓、肝臓などの組織からオルガノイド作製に適用されました(Bartfeld, et al., 2015; Gao, et al., 2014; Huch, et al., 2015; Sato, et al., 2011)。
オルガノイド培養は、下記に示すような制限もあります。
- 神経細胞、免疫細胞、および間質細胞によって提供される完全な細胞ニッチを再構成することができず、生理学的関連性を制限する。
- 血管新生ができないため、in vitroでオルガノイドの成長の可能性が根本的に制限される。
- 未定義のマウス由来ECMを必要とするため、ロット間の変動が懸念され、ゼノフリー培養が行えない。
- 固化したゲルECMでは、薬物や化合物の浸透性がオルガノイドの到達に影響を与える可能性がある。
- オルガノイドは本質的にHeterogeneousであり、Homogeneousな細胞株よりもin vivo組織として適すが、培養時におけるオルガノイドのサイズと形態の範囲が、表現型スクリーニングを困難にする可能性がある。
このような制限はありますが、オルガノイドは前臨床研究において化合物スクリーニング、臓器や組織の発達研究、および疾患の理解のためのモデルとして利用されています(Bartfeld, et al., 2015; Chio, et al., 2016; Dekkers, et al., 2013; Huang, et al., 2015; Sato, et al., 2011; van deWetering, et al., 2015; Verissimo, et al., 2016; Vlachogiannis, et al., 2018)。現時点での技術的な制限を克服するアプロ―チとして、間質細胞または免疫細胞とのオルガノイド共培養、マウス由来成分の代替として定義されたECMの使用、そして表現型スクリーニングをより適切にサポートする高度なイメージングおよび分析方法が挙げられます。
追加しました。
オルガノイド培養における重要なポイント
使用するECMの選択
ECMは、オルガノイド培養系の重要な要素です。公開されているオルガノイド培養プロトコルの多くは、市販されているマウスEHS肉腫由来の未定義のECMを利用しています。生物学的および化学合成により定義されたECMも使用できますが、オルガノイド培養で広く検証されていません。それぞれのECMには固有の特性があり、培養目的では同等とは見なされていません。さらに、未定義のECMはロット間の差異があり、培養工程に影響を与える可能性があります。一貫した培養工程のために、オルガノイドはモデル推奨されたECMで維持する必要があり、未定義のECMのロットは、成長をサポートすることを確認するために事前検証する必要があります。ECMを切り替えるときは、オルガノイドモデルが期待どおりに成長し、目的の表現型や遺伝子型が維持されていることを実験的に判断します。
培地の選択と準備
オルガノイド培養培地は市場ではほとんど販売されていないため、多くの場合で培地は自作する必要があります。オルガノイド培養培地の組成は複雑で、約10~12種類の成分を必要とし、これらは馴化培地には含まれていません。これら構成成分には、様々な低分子化合物や成長因子などが含まれており、複数のメーカーから調達し、慎重に準備して保管する必要があります。
オルガノイド培養培地は標準化されておらず、オルガノイドモデルを開発している研究所は、成功実績に基づいて独自の「自作」培地を用いています。その結果、同じ種類のオルガノイドモデルに対して複数の異なる培地が利用され、公開されています。複数の培地が同じモデルの増殖をサポートする可能性がありますが、培地を変更すると、その表現型や遺伝子型が変化する可能性もあります。
※ がんオルガノイド用培地の組成例は、表1をご覧下さい。
※ ATCC®の各種オルガノイドの培養に最適化されたOrganoid Growth Kitはこちらをご覧下さい。
コンディション培地(馴化培地)
1種類または複数の細胞株から作製された馴化培地は、多くのオルガノイド培養培地の成分として使用されており、完全培地の70%を占めることもあります。オルガノイド培養に必要な因子(Wnt-3A、R-spondin1、Nogginなど)を発現・分泌する細胞株を用意し、その細胞培養上清を回収して駿化培地として使用します(一例は表5参照)。駿化培地が利用される主な理由は2つあります。1つ目は、市販の精製組換え体タンパク質を大量に購入するよりも安価となることです。2つ目は、精製組換え体タンパク質よりも、駿化培地の方が細胞培養において生物学的活性を示すとされることです。ただし、駿化培地の生成のためには、細胞株を準備して培養する必要があります。細胞株が異なれば、駿化培地の作製方法が異なる場合もあります。Wnt-3AおよびR-spondin 1用の駿化培地の作製に使用されている市販の細胞株を利用するプロトコルは、その他関連ウェブページをご覧下さい。
表5:市販で購入可能な馴化培地生成用細胞株
| メーカー | 細胞株名 | 分泌因子 | 商品コード |
|---|---|---|---|
| ATCC® | L-WRN | Wnt-3A, R-spondin3, Noggin | CRL-3276TM |
| ATCC® | L Wnt-3A | Wnt-3A | CRL-2647TM |
| EMD Millipore | R-Spondin 1発現293T細胞株 | R-spondin1 | SCC111 |
ドーム形成培養のスケールアップ制限
このページでは、標準的な組織培養用プレート・ディッシュを使用して、ドーム形成したECM液滴内でオルガノイドを培養するという、現在広く採用された実験方法について説明しています。一方で、この方法は標準的なフラスコや多層容器へ液滴を手作業で分配するのが非常に困難であるため、本質的にスケールアップに制限があります。ルーチン培養と増殖には、10 cm2ディッシュの使用をお勧めします。10 cm2ディッシュは、大型の培養容器と比べてインキュベーターのスペースを大幅に占有せず、取り扱いも簡単であり、十分な収量を得ることができます
追加しました。
トラブルシューティング
オルガノイド培養を特徴付ける項目(三次元増殖、複雑な培地組成、未定義のECM、複数の馴化培地)の多くが、オルガノイド培養の安定性と再現性に影響を与える潜在的な原因となります。ECMは温度に敏感であり、継代や播種時に完璧なタイミングでECMを取り扱うためには、実践的な練習が必要です。解凍直後やルーチン培養時に最も失敗の原因となりうるのは、培地が正しく調製されていないことや、培地の使用期限が切れていることが挙げられます。すべての培地成分を慎重に準備して保管することが重要です。組換え体タンパク質と低分子化合物については、小さなバイアルサイズ(理想的には1回に使用する分)を購入し、製造元の指示に従って保管し、使用直前まで再構成は控えて下さい。再構成は、購入元の説明書の指示に従って下さい。正しく保存した場合でも、再構成した成分は時間の経過とともに活性を失う可能性がありますが、凍結乾燥品は適切に保存した場合、数年間保存できる場合もあります。オルガノイド培養で発生する一般的な問題と解決策は、表6をご覧下さい。
表6:初代組織由来オルガノイドの三次元培養の際に起こりうる問題点
| 問題 | 考えられる原因と解決法 |
|---|---|
| オルガノイドがピペットチップやセロロジカルピペットの内側に付着します | 一部のオルガノイドモデルは粘着性が強いため、毎回新しいピペットチップやセロロジカルピペットを準備し、基礎培地で事前にリンスし、接着力を低下させることが重要です。この方法で付着を防げなかった場合、0.2 μmフィルター滅菌済み0.5~1%BSAを含むDMEM:F12溶液でリンスして下さい。 |
| 解凍後のオルガノイドが観察できない、または形態が悪いように見えます |
|
| 継代後のオルガノイドが回復しません | オルガノイドは、その生存能や形態にすぐ影響が出なくても、増殖能とオルガノイド形成能が失われる可能性があります。正常に培養されているように見えたとしても、継代後にオルガノイドが再形成されない、または形態が大幅に変化する場合は、そのオルガノイドの培養は中止し、新鮮な培地で再度オルガノイドを解凍・培養する必要があります。新しく調製した培地でも培養が上手くいかない場合、培地成分の失活や有効期限切れの可能性が考えられます。 |
| ECMがドームを形成せずウェル全体に広がってしまいます |
|
| オルガノイドが沈んでプラスチックに付着します | オルガノイドはドームが重合するまで時間経過とともに沈むため、播種する際は迅速に作業を行う必要があります。オルガノイドの沈下を最小限に抑えるため、播種直後に培養容器を逆さにして37℃インキュベーターに戻します。 |
| オルガノイドの数が異なるドームやオルガノイドが含まれないドームがあります | 細胞懸濁液はECM/オルガノイドを含むチューブ内で時間の経過とともに沈むため、播種する際は迅速に作業して下さい。定期的にピペッティングして混合し、播種中に均一な懸濁液を確保します。 |
| オルガノイドが全く解離しない、または解離しにくい |
|
| 解離中または解離後に、白い糸状またはふわふわした物質が見える | 解離処理によって、分解が困難なDNAが放出される場合があります。この現象が発生した場合は、解離中にDNaseⅠ(200 U/ml)をバッファーに添加した後、よく混ぜます。 |
| ECMの粘度が高くピペッティングできなくなる | 温度が十分に上昇すると、ECMは重合してゲルを形成します。 使用直前までECMを氷上に静置し、作業は迅速に行って下さい。ECMの使用量が多い場合、チューブを定期的に氷上に戻して冷却し、使用前にピペッティングで再度混合します。 事前にチューブとピペットチップを冷却しECMの温度を維持することもできますが、通常は必要ありません。 |
| 培養中にオルガノイドの形態が変化する | ルーチン培養では、一貫した形態を取る必要があります。培養形態の変化は、培養条件に問題がある可能性があります。
|
| 生存率が低い | オルガノイド培養では、細胞デブリやECM、細胞塊が存在するため、トリパンブルーによる生存率の評価は難しいかもしれません。可能であれば、モデル固有の情報を参照し、予想される生存率を確認して下さい。健康な状態では、通常70~90%の生存率を示します。解凍直後や解凍後最初の継代の際は、見かけ上の生存率は低くなります。継代時に細胞デブリや死細胞を洗浄除去し、生存したオルガノイド密度が増加すると、時間経過とともにオルガノイドの生存率が上昇します。 |
| 成長が遅い | オルガノイドモデルによって、成長率は大きく変化します。例えば、7日ごとに1:6に分割するモデルもあれば、10日ごとに1:2に分割を必要とするモデルもあります。モデル固有の情報がある場合は、予想される成長率を確認して下さい。複数回の継代を伴う培養の過程で増殖速度が遅く見える場合は、新鮮な完全増殖培地や馴化培地の使用を検討して下さい。 |
| 同じ組織由来のオルガノイドモデルが異なる形態をとります | これは正常です。オルガノイドの形態は必ずしも組織に依存する訳ではなく、主にドナー/疾患特性を反映する傾向にあります。可能なら、モデル提供元の培養画像を参照し、予想される形態を確認して下さい。 |
| ドームが表面から剥がれている、または穴が開いていたり損傷しているように見える |
|
追加しました。
予想されるオルガノイドの状態・形態
一般的に、解凍直後に培養すると個々に分散した細胞、細胞塊、無傷の小さなオルガノイドが観察されます(モデルによって差はあります)。オルガノイドは培養から3~7日間で形成され、滑らかで明確な境界を持つ小さなリング状または球状の構造を形成します。7~14日後には、大きくハッキリとした形のオルガノイドが観察できます。モデルごとに形態の差は大きく、固形の小石や大きな嚢胞状の風船のようなオルガノイドまでありますが、一貫した密度で維持した場合、特定のモデルの培養過程で一貫性を保つ必要があります。通常、オルガノイドは上記のプロトコルに従って調製した場合、7~10日ごとに継代の準備が整います。オルガノイド中心が暗くなる(内腔にデブリが蓄積)ことが継代の指標となりますが、すべてのモデル/組織に生じる訳ではありません。解凍直後、継代の準備が整った時点、継代直後のオルガノイドモデルの形態例は、図2をご覧下さい。
追加しました。
オルガノイド培養に必要な作業時間
一般的な細胞培養方法と比較して、3Dオルガノイド培養は作業に時間がかかります。特に、一般的な細胞株よりも継代処理に時間がかかり、ゲル化したECMを酵素処理や機械的な破壊で取り除き、オルガノイドを分散させる必要があります(オルガノイドモデルによる)。
最も検討に時間がかかるのは、複雑な培地を一から作る必要性、培養容器の予熱、ECMの取り扱い、駿化培地の産生など培養の準備に関してです。細胞株とプロトコルによっては、駿化培地の産生に1週間以上を要する場合があり*3、実質的な作業時間は始終2時間以内ですが、数日かかる手順であるため、事前に生成する必要があります。
*3 例:L Wnt-3A(Protocol for the generation of Wnt-3A conditioned media from Wnt-3a expressing L-cells.)、
U.S. Public Health Service Guidelines; Biosafety in microbiological and biomedical laboratories (6th edition).
オルガノイド培養を始める前に、培地調製に必要な組換え体タンパク質、低分子化合物、ペプチドを再構成し、1回に使用する量に小分けする必要があります。完全増殖培地は事前に準備する必要があり、特に培地添加物を初めて再構成し小分けする場合、作業に数時間かかることもあります。1 ml以上のECMは4℃で一晩かけて解凍する必要があるため、ECMの分注には少なくとも2日間かかります。
オルガノイドの播種または継代をする日の朝に、事前に準備した完全増殖培地を室温に戻し、必要量のECMを氷上で解凍し、組織培養容器を予熱します。これらの作業には2〜3時間かかります。適切に準備すれば、1バイアル分のオルガノイドの解凍・播種は1時間以内に行えます。解凍後の最初の継代(6ウェルプレートから2つのウェル)は1時間以内に完了しますが、維持する培養容器の数が増えるとさらに時間がかかります。
追加しました。
その他関連ウェブページ
オルガノイドなどがん研究/新規治療法開発に有用なHCMIモデル:HCMIの次世代がんモデル
Wnt3A、R-spondin 3、Nogginを含む馴化培地を調製できる細胞株:ATCC® L-WRN Cell
追加しました。
引用文献
- Bartfeld, S., et al., Gastroenterology, 148(1):126~136(2015). [PMID:25307862]
- Chio, I. I. C., et al., Cell, 166(4), 963~976(2016). [PMID:27477511]
- Laboratory stock solutions and equipment. Curr. Protoc. in Cell Biol., 1, A.2A.1–A.2A.10. doi: 10.1002/0471143030.cba02as00(2001).
- Dekkers, J. F., et al., Nat. Med., 19(7), 939~945(2013). [PMID:23727931]
- Gao, D., et al., Cell, 159(1), 176~187(2014). [PMID:25201530]
- Huang, L., et al., Nat. Med., 21(11):1364~1371(2015). [PMID:26501191]
- Huch, M., et al., Cell, 160(1~2), 299~312(2015). [PMID:25533785]
- Sato, T., et al., Gastroenterology, 141(5), 1762~1772(2011). [PMID:21889923]
- Sato, T., et al., Nature, 459(7244), 262~265(2009). [PMID:19329995]
- Shamir, E. R., & Ewald, A. J., Nat. Rev. Mol. Cell Biol., 15(10), 647~664(2014). [PMID:25237826]
- van de Wetering, M., et al., Cell, 161(4), 933~945(2015). [PMID:25957691]
- Verissimo, C. S., et al., Elife, 5, e18489. doi: 10.7554/eLife.18489(2016). [PMID:27845624]
- Vlachogiannis, G., et al., Science, 359(6378), 920~926(2018). [PMID:29472484]
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。


