知りたい!これからの老化研究
東京大学医科学研究所 中西 真 先生
掲載日情報:2022/11/01 現在Webページ番号:69947
追加しました。
-
2025/11/04
試薬 特別価格
[KOM]低分子化合物 20%OFF・InVivoKines/B-Xpander 30%OFFキャンペーン[~2026/02/27]
期間:2025/11/04 ~2026/02/27
Adipogen Life Sciences(KOM)

がんや心血管系疾患、神経変性疾患など多くの疾患群の最も大きな危険因子の一つは老化である。興味深いことに、カメやハダカデバネズミなど一部の生物は年老いても典型的な老化様症状を示さず、死亡率も上昇しない。このことは、老化は必ずしも生命にとって必須の事象ではなく回避できる可能性を示している。もし人類が老化を克服できれば多くの疾患から解放されるかもしれない。最近の研究から加齢に伴う臓器・組織の機能低下の原因の一つが、老化細胞などの炎症誘発細胞が蓄積することによる過剰な慢性炎症であることが分かってきた。加齢に伴う臓器・組織の慢性炎症を抑制し、老化を防ぐという目的で老化細胞除去薬の開発が進められている。
老化を制御する仕組みとは?
ヒトの最大寿命は120歳である。誰もが常識として感じている事象が科学的に人工統計データを用いて証明されたのは2016年のことである1。これまで人類の平均寿命は年々上昇し、またモデル生物では環境や遺伝学的介入により決められた寿命が変動することから、最大寿命も流動的に変化する可能性が指摘されていた。しかし、実際には最大寿命の伸びはすでに一定のラインに達しているか、むしろ減少してきていることが分かった。さらに、老化はすべての生物で見られる生命にとって必須の事象であるという常識(?)も、カメやハダカデバネズミなど一部の生物では加齢に伴う死亡率の上昇がなく、典型的な老化現象が見られないことが近年明らかにされた2、3、4。一方、ヒトは加齢に伴い急激に死亡率が上昇し、多くの老化表現を示す典型的な生物である。それではヒトの老化は何によって制御されているのだろうか?近年になり加齢に伴い老化細胞などの炎症を誘発する細胞が蓄積し、過剰な微小慢性炎症が様々な臓器・組織に起こることが老化現象の基本メカニズムであることが分かってきた。
個体内の老化細胞とは?
それでは加齢に伴い蓄積する老化細胞とはどんな細胞なのだろうか?これまでの老化細胞の研究の多くは培養細胞を用いたものであり、個体内で老化細胞がどこに、いつ、どの程度蓄積しているのか、またどんな性質を持っているかについてはあまり分かっていなかった。我々は、蛍光強度の高い赤色蛍光タンパク質tdTomatoを用いて、個体内のp16*1陽性細胞の追跡が可能なマウス“p16-CreERT2-tdTomatoマウス”を作製した5。これは、p16INK4a遺伝子座のエクソン1αをCreERT2リコンビナーゼ遺伝子で置換したp16-CreERT2マウスと、Creリコンビナーゼ活性依存的にtdTomatoを発現するRosa26-CAG-lsltdTomatoマウスを交配させたものである。p16-CreERT2-tdTomatoマウスにタモキシフェン*2を投与すると、CreERT2が核内に移行しp16陽性細胞が赤色に蛍光発色する。
このマウスモデルを用いて、個体内でp16陽性細胞が老化細胞としての特徴を備えているかを解析した。その結果、個体内のp16陽性細胞は増殖せず、様々な臓器で加齢とともに蓄積していくことが分かった。興味深いことに、老化した個体であっても老化細胞は数%を占めるに過ぎない。しかし、臓器障害に関わる遺伝子群を発現することで、機能低下に寄与していることが推察される。実際、腎臓を用いた1細胞トランスクリプトーム解析から、p16陽性細胞は主に尿細管上皮細胞に同定され、それらの性質は腎障害や炎症に大きく関わっていることが示された(図1)。これらのことから、個体内のp16陽性細胞は老化細胞としての性質を示しており、これらの蓄積が加齢に伴う臓器・組織の機能低下を引き起こしていることが示唆された。
*1 p16:細胞周期の制御に関わるCDK4やCDK6を抑制する腫瘍抑制タンパク質。
*2 タモキシフェン:エストロゲンと競合してエストロゲンレセプターに結合する抗腫瘍物質。

腎臓を構成する細胞の1細胞トランスクリプトーム解析
(左上)腎臓細胞のUMAP図
(左下)各種細胞におけるp16陽性細胞の割合
(右)近位尿細管細胞における1細胞トランスクリプトーム解析 p16陽性細胞は赤線で囲った部分
老化細胞除去による老化改善効果
2011年、老化マーカー遺伝子p16INK4a陽性細胞に、薬剤投与依存的にアポトーシスを誘導し、老化細胞を除去できる遺伝子改変マウス(INK-ATTACマウス)が開発された。このマウスと早老症マウス(BubR1H/Hマウス)を交配させて老化細胞を除去すると、様々な老年病の発現が改善することが報告され、老化細胞除去の有効性が明らかとなった。これを受け、老化細胞特有のアポトーシス抵抗性の性質を標的として、アポトーシス抑制機構を解除することによって老化細胞を死滅させる技術の開発が進められた。その結果、チロシンキナーゼ受容体(Receptor tyrosine kinase:RTK)阻害剤のDasatinibと、フラボノイド系ポリフェノールのQuercetinの併用や、BCL-2ファミリーの阻害剤であるABT-263(Navitoclax)、ABT-737、A-1331852、A-1155463などが老化細胞除去薬(セノリティクス薬)として開発された(図2)。その他にも、FOXO4阻害剤やHSP90の阻害剤である17-DMAGの早老症マウスにおける症状改善効果が報告されている6、7。しかしながら、これらの薬物の多くはアポトーシスという細胞の生存そのものを標的とするため、ヒトに投与した場合重篤な副作用が懸念されている。
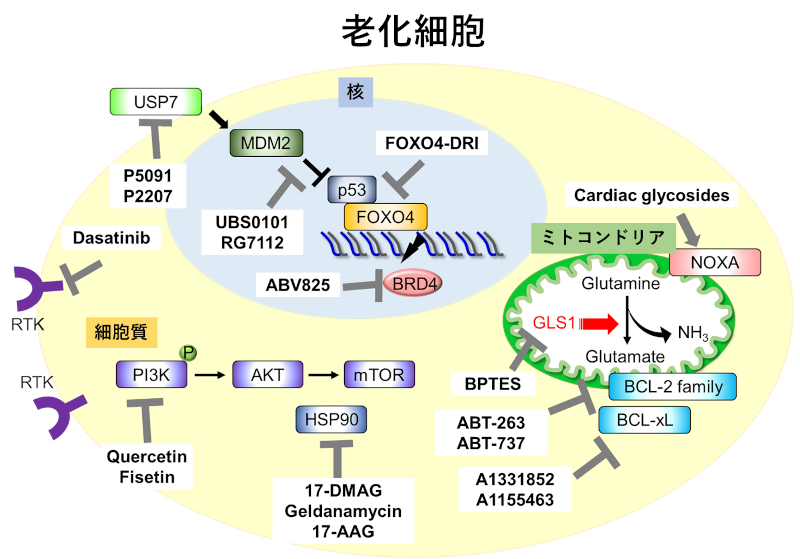
核、ミトコンドリア、および細胞質を標的にしたセノリティクス薬の作用機序。多様な分子を標的とした薬物が開発されているが、主には老化細胞のアポトーシス抑制作用を阻害するものである。
我々は副作用の少ないセノリティクス薬を開発する目的で、老化細胞の生存に必須の遺伝子をスクリーニングした。その結果、グルタミナーゼ1(GLS1)が老化細胞の生存に必須の遺伝子であることを明らかにした8。老化細胞のリソソームにはミスフォールドタンパク質が凝集体を形成してリソソーム膜に損傷を与えており、その結果細胞内酸性化をきたしている。GLS1にはGAC型とKGA型の2つのアイソフォームが存在し、老化細胞ではKGA型が特異的に発現誘導されている。KGA型GLS1転写産物には細胞内酸性化に反応して転写産物を安定化する領域があり、この領域が老化細胞におけるKGA型の発現誘導に必須であることが分かった。このことから、老化細胞内の酸性化を中和するためにGLS1により産生されたアンモニアを利用していると考えられた。
20ヶ月齢のマウスに週2回合計9回GLS1阻害剤であるBPTESを投与したところ、腎臓においては糸球体硬化率やマクロファージ浸潤が軽減し、腎機能の指標である血清クレアチニンや尿素値も改善した。肺では線維化率の改善、肝臓ではマクロファージ浸潤の軽減と血清アルブミン、遊離脂肪酸値などの機能が改善した。さらに握力や捕まり時間などの筋力や、高サイトカイン血症も改善した。さらに、高脂肪食摂取による動脈硬化やインスリン感受性なども有意に改善した(図3)。以上のことから、GLS1活性の阻害はマウス個体内において老化細胞を選択的に除去し、それに伴い多くの加齢に伴う臓器機能の低下や老年病発症が改善されると考えられた。重要なことに、ヒトにおいてもGLS1の発現は加齢とともに増加することから、今後GLS1阻害剤によるヒトを対象とした老化細胞除去療法の確立とその臨床応用が期待される。

おわりに
これまでの老化研究は線虫やショウジョウバエなどのモデル生物を用いた研究か、培養細胞を用いた研究が中心となり多くの知見を得てきた。しかしながら、最終的に哺乳動物の老化機構を明らかにするためには、これらの知見をマウスモデルに応用していく必要がある。さらにマウスで得られた知見はヒトに応用されなければならない。前にも述べた通り、動物種の中には典型的な老化表現を示さないものもあるため、老化は生物種によりかなり多様であることが予想される。今後、シングルセル解析や最先端のイメージング技術などを駆使することで、老化機構が明らかとなり人類が多くの疾患から解放されることを期待したい。

参考文献
- Dong, X., et al., Nature, 538(7624),257~259 (2016).[PMID:27706136]
- Jones, O.R., et al., Nature, 505(7482),169~173 (2014).[PMID:24317695]
- Reinke, B.A., et al., Science, 376(6600),1459~1466 (2022).[PMID:35737773]
- da Silva, R., et al., Science, 376(6600),1466~1470 (2022).[PMID:35737795]
- Omori, S., et al., Cell Metab., 32(5),814~828 (2020).[PMID:32949498]
- Zhang, L., et al., FEBS J., doi:10.1111/febs.16350 (2022).[PMID:35015337]
- Kirkland, J.L., and Tchkonia, T., et al., J. Intern. Med., 288(5),518~536 (2020).[PMID:32686219]
- Johmura, Y., et al., Science, 371(6526),265~270 (2021).[PMID:33446552]
関連製品
追加しました。
お問い合わせ先
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。

