知りたい!シナプスの構造と機能を制御するグリア
東京大学 大学院薬学系研究科 薬品作用学教室 小山隆太准教授
掲載日情報:2024/01/17 現在Webページ番号:66062
追加しました。

シナプスは脳内の情報伝達の基本単位であり、ニューロンの相互作用に焦点を当てた研究により、シナプスの構造、機能、および動的変化について多くの発見がなされました。そして最近の神経生物学の進展により、ニューロン周囲に存在するグリア、特にミクログリアとアストロサイトのシナプス動態における重要性が浮き彫りになってきました。本稿では、私たちの最近の研究と今後の展望を通じて、グリアがシナプスの接続性、可塑性、および個体の行動に与える影響についてご紹介します。
脳内マクロファージと呼ばれることもあるミクログリアは、従来から神経炎症や免疫応答の調節に関与するとされてきました(なお、脳内マクロファージという呼称、神経炎症という単語、ミクログリアの活性化という表現、等々の使用には注意が必要です。詳細は、私たちミクログリア研究者が最近まとめた総説1 を是非ご参照下さい)。しかし、最新の研究により、ミクログリアはシナプスの再編成にも積極的に関与し、発達段階や神経活動に応じて重要な役割を果たしていることが示されました2。ミクログリアは高い運動性を持つ突起でシナプスと動的に相互作用し、神経回路の精密化に重要な役割を果たします。
また、アストロサイトもシナプス機能において欠かせない存在です。アストロサイトについては、ニューロンの代謝支援や細胞内外イオンバランスの維持機能など多くのことが明らかになっています。そして、最近の研究では、アストロサイトがシナプス伝達や可塑性、さらにはシナプス剪定にも関わることが報告されています。また、アストロサイトはグリオトランスミッターと総称される物質の放出や神経活動に応じたシナプス伝達の調節を通じて、シナプスの可塑性を制御する役割が示されています。
ミクログリアとアストロサイトは役割を分担しながら協調して(もしくは競合して)、シナプスの構造と機能に影響を与えています。このようなグリアとシナプスの相互作用は、神経回路の形成と脳機能の発揮において重要な要素であり、互いに切り離せない関係にあります。したがって、シナプスの研究には、グリアの影響を考慮することが必要不可欠です。今後、グリアがシナプスの構造と機能を制御するメカニズムがより明らかにされることで、脳の機能や障害の理解が一層進展することが期待されます。
神経回路形成機構の研究からグリア研究との出会いまで
学部から大学院までは、東京大学にて松木則夫先生と池谷裕二先生のご指導の下、脳内の神経回路形成を制御する分子細胞メカニズムに興味を持って研究を進めました。そして、正常発達における神経回路形成メカニズムに留まらず、慢性の脳疾患であるてんかん脳における異所性神経回路の形成メカニズムの解明を目的とした研究を精力的に行いました。一例として、小児期の熱性けいれんが興奮性GABA シグナリングを介して海馬顆粒細胞の移動と局在の異常を誘導し、将来のてんかん発症に関与することを発見しました3。
当時の私は、グリアにはあまり興味がありませんでした。しかし、生理学研究所の池中一裕先生や田中謙二先生など、グリア研究に情熱を注いでいる先生方との交流を通じて、グリアに興味を持つようになりました。また、神経解剖学者の濱清先生から見せていただいたニューロンを包みこむグリアの電子顕微鏡画像に衝撃を受け、ニューロン・グリア相互作用の研究をすることを決意しました。その後、コールドスプリングハーバー研究所のグリアミーティングで、ハーバード大学で独立直後のBeth Stevens 先生と出会い、学術振興会の海外特別研究員として彼女のラボで留学する機会を得ました。留学中は、発達期の中枢神経系における未熟なシナプスが補体分子によってタグ付けされ、補体レセプターを有するミクログリアによって貪食されることを発見する画期的な研究に携わりました4。この時期にグリア生物学の重要さに触れ、脳という臓器の捉え方が、私の中で大きく変化しました。
帰国後は、ニューロンとグリアの構造的および機能的な相互作用の研究を展開し5、アストロサイトの機能を操作する新技術などを開発しながら6、脳発達や脳疾患へのグリアの関与を検証してきました。一例として、自閉症モデルマウスを利用し、自閉症へのミクログリアの関与と、自閉症の治療における運動の有効性を示しました7(図1)。

図1:自閉症研究の概要。自閉症ではミクログリアによるシナプス貪食が不全となり、過剰なシナプスが残存する。そこで、運動により一部のニューロンが活性化され神経活動の差が生じると、ミクログリアによるシナプス貪食が促進され、神経回路が正常化される。文献7より改変して掲載。
自閉症は、社会的コミュニケーション障害を主症状とする神経発達障害ですが、その発症メカニズムは十分には解明されていません。私たちは、妊娠中に免疫が活性化されたマウス(母体免疫活性化)から生まれた仔マウスは自閉症様行動を示し、発達期におけるミクログリアによるシナプス貪食が不全となることで、シナプス密度が増加することを発見しました。そして、マウスに自発的な運動をさせると、ミクログリアによるシナプス貪食が促進され、自閉症様行動が改善されることを発見しました。この研究から、自閉症の発症および治療におけるミクログリアの重要性が明らかになりました。また、長崎県立大学の柴崎貢志先生らとの共同研究では、社会性ストレスによる脳内の温度上昇が、神経新生を抑制するメカニズムを明らかにしました。すなわち、神経幹細胞が発現する温度受容体 transient receptor potential vanilloid 4(TRPV4)の活性化が、細胞死シグナルを介したミクログリアによる貪食を誘導することを発見しました8(図2)。ほかにも、ミクログリアによるシナプス貪食の新規分子メカニズム、グリア依存的な幻聴のメカニズム、グリアを標的とした抗てんかん発作薬の創薬、赤血球貪食がグリアの遺伝子発現パターンに与える影響などの研究を遂行中です。
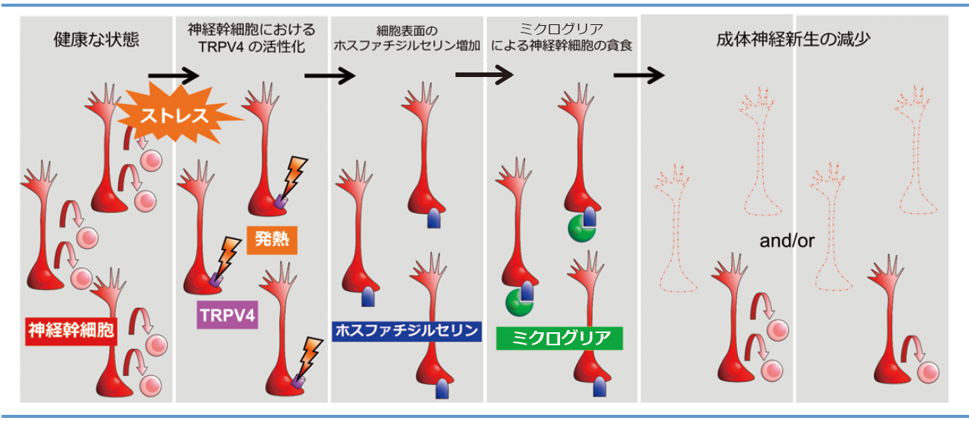
図2:脳内温度研究の概要。健康な状態の脳では、神経幹細胞による成体神経新生が生じている。ストレスにより発熱が生じ、TRPV4 が活性化すると、神経幹細胞の表面にホスファチジルセリンが露出する。ミクログリアはホスファチジルセリンを認識し、神経幹細胞を貪食する。文献8より改変して掲載。
新しい培養系の開発と今後の研究展開
神経科学におけるシナプス研究の歴史は長いですが、シナプスの構造と機能の変化は主にニューロン同士の関係に焦点が当てられ、シナプス周囲にはグリアが密に存在するにも関わらず、グリアの関与についてはまだ完全には理解されていない側面があります。このような状況になった理由の一つは、適切な手法がまだ開発されておらず、グリアの関与を詳細に調べることができていないことかもしれません。例えば、既存のシナプス貪食研究(私が留学中に関わった文献4 の研究も含む)は、組織化学染色と電子顕微鏡の画像解析に依存しており、生きたニューロンからミクログリアがシナプスを貪食するか否か、そしてシナプスを貪食されたニューロンは生存できるのか、といった、神経回路の形成や再編成にとって非常に重要な疑問やその分子機構を解明するには至っていませんでした。
適切な手法を開発し、グリアの関与を探求することで、シナプス変化の分子メカニズムと脳の機能との関係について新たな知見が得られることが期待されます。また、これにより、シナプスという存在の捉え方や解釈に変革を起こすことができます。シナプス可塑性におけるグリアの役割を解明するために必須なのは、シナプスとグリアの相互作用を「観察」して「操作」する系の開発です。高解像度ライブイメージングによる「観察」は、微小構造であるシナプスとグリア突起の相互作用という現象を正確に捉えるために必要で、「操作」は観察された現象の分子メカニズムを知るために不可欠です。このような実験には培養系が適していますが、従来の培養法では、特にグリアがin vivoと大きく異なる形態を示すために不適切でした。そこで、私は、帰国後10年間でこの系を完成させると心に決めました。そして、当時は学生で、現在は東京大学 特任研究員の安藤めぐみ博士の尽力の結果、ようやく理想に近い培養系を作り上げました。この培養系を利用して、ミクログリアが生きたニューロンから、軸索をちぎることなくシナプスを貪食し、シナプスが貪食されたニューロンは死ぬことなく生き続けることを初めて発見しました。この成果は、シナプス貪食過程を明確に可視化しており、神経科学領域の発展にとって意義深いものと考えます。
さらに、私と安藤博士は、ニューロンとグリアの複合体をひとつのユニット、 すなわちグリオニューロナルユニット(Glioneuronal unit,GNU)と捉えて(図3)、GNU を培養系で再現すべく上述の実験系にさらに改善を加えました。その結果、各種細胞のin vivoにおける形態を保持したまま三次元培養したGNU 培養系を完成させました(図3)。ニューロンと複数種のグリアの構造が保持されているGNU 培養系を活用して、私たちは今後のシナプス・グリア相互作用の研究に貢献してゆきたいと思います。特に、これまで主にニューロン間の相互作用のみで説明されてきたシナプス可塑性に、グリアが関与するモデルを提唱し、そのメカニズムを明らかにしてゆきます。GNU 培養系に各種脳疾患の状態を反映させることも試みており、これが完成すれば、脳疾患の発症予測や創薬スクリーニングにも役立つと考えています。これからも、ライブイメージングでリアルタイムな現象を捉え、その分子機構を明らかにすることを重視し、「世界で初めて」見つける生命現象を追求します。
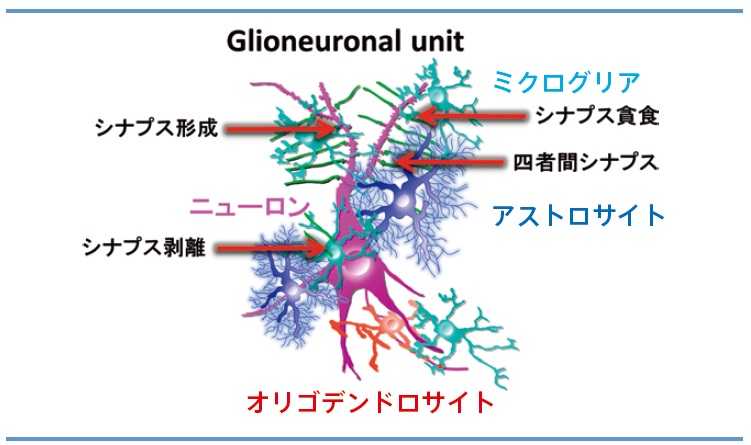
図3:新規三次元培養システム・グリオニューロナルユニット(Glioneuronalunit,GNU)開発のための概念図。シナプスの周囲には、ミクログリア、アストロサイト、そしてオリゴデンドロサイトが密に存在する。シナプス可塑性の原理を知るためには、これらの細胞とシナプスの相互作用を詳細に研究する必要がある。
謝辞
本稿で紹介した研究は、特に、文部科学省科研費(20H05897、学術変革領域A「グリアデコーディング」)およびJSTさきがけ(JPMJPR18H4)による支援を受けて行いました。また、本稿では紹介しきれなかった多くの先生方のご指導と、一緒に研究を進めてくれた学生との共同の研究成果になります。この場をお借りして深謝致します。
参考文献
- Paolicelli, et al., Neuron, 110(21), 3458~3483(2022).[PMID:36327895]
- Andoh and Koyama, Dev Neurobiol., 81(5), 568~590(2021).[PMID:33583110]
- Koyama, et al., Nad Med., 18(8), 1271~1278(2012).[PMID:22797810]
- Schafer, et al., Neuron, 74(4), 691~705(2012).[PMID:22632727]
- Onodera, et al., Glia, 69(4), 890~904(2021).[PMID:33119934]
- Zhou, et al., PNAS, 118(3), e2016584118(2021).[PMID:33452135]
- Andoh, et al., Cell Reports, 27(10), 2817~2825(2019).[PMID:31167129]
- Hoshi, et al., Sci Adv., 7(48), eabj8080(2021).[PMID:34826234]
追加しました。
お問い合わせ先
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。

