知りたい!核酸医薬による がん治療の展望
国立がん研究センター研究所 分子病理分野・研究員 小林 祥久 先生
掲載日情報:2023/06/15 現在Webページ番号:65973
追加しました。

日本人の2人に1人が一生のうちにがんと診断され、5人に1人ががんで亡くなってしまいます。早期発見・早期治療による根治を目指す一方で、進行期や再発したがんに対しては薬物療法のさらなる開発が必要です。
がん細胞だけを攻撃する理想的な治療を目指して、これまで主に発がんタンパク質を標的とした治療薬開発が行われ、分子標的治療が確立してきました。一方で、神経・筋疾患に対する新たな治療薬として、細胞内の核酸(DNA/RNA)を直接標的にできる核酸医薬への注目が近年高まっています。
本稿では、偶然のセレンディピティによって最多の発がん遺伝子ファミリーRAS の弱点を発見し、その機序に基づいて核酸医薬をがん治療に応用した試みとその展望について紹介します。
発がんタンパク質を標的としたがん治療
肺がんは最も死亡者の多いがん種で、日本だけで1年間に約13万人が罹患し、7万人が亡くなります。肺がんのうち約7割を占める肺腺がんでは、EGFR、EML4-ALK などの発がんドライバー遺伝子異常が発見され、これらの発がんタンパク質を標的とした低分子化合物によって「がん細胞だけを攻撃する」理想的な分子標的治療が確立しています(図1)。
しかし、一度劇的に効いてもがんはあらゆる薬剤に対して次第に耐性を獲得して効かなくなってしまうため根治はできないのが現状です。薬剤耐性機序は大きく①標的遺伝子の二次変異によって標的タンパク質の薬剤結合ポケットの構造が変わり、薬が結合できなくなるもの、②標的遺伝子とは別の発がん遺伝子異常からの増殖シグナルによるもの、③腺がんから他の病理組織型に転換するものなどに分類されます。
私はその克服を目指してこれまで幅広く薬剤耐性機序の研究に取り組んできました(文献1~4)。
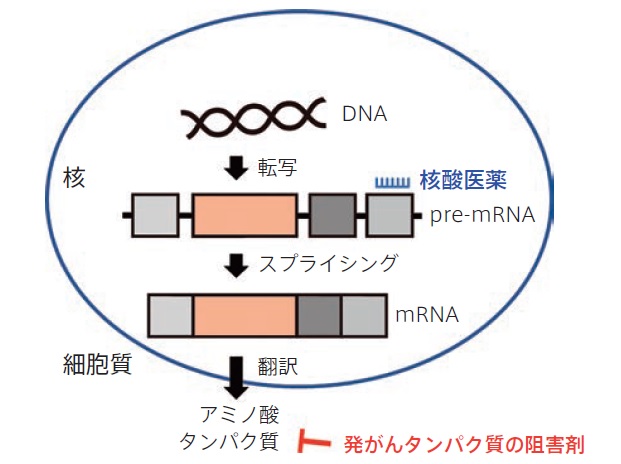
図1 低分子化合物と核酸医薬の標的
核酸医薬による神経・筋疾患の治療
核酸医薬とは、化学合成された20塩基長程度の連結したオリゴ核酸で構成され、タンパク質に翻訳されることなく直接生体に作用する医薬品の総称です。アンチセンス、siRNA、アプタマー、CpG オリゴなど様々なものがあり、タンパク質だけでなく標的遺伝子の核酸に直接作用できることが特徴です(図1)。
主な目的は2つあり、つ目は標的遺伝子の発現を低下させることです。生命科学全般の実験では、標的遺伝子を短時間ノックダウンするsiRNA や長時間ノックダウンするshRNA に馴染みがあるかと思います。2つ目は、転写後のpre-mRNA からイントロンを除去してエクソンのみを繋ぐプロセスである「スプライシング」を制御することです。本稿では、この核酸医薬ならではのスプライシング制御に注目します。
Pre-mRNA を標的としたSplice-switching oligonucleotide(SSO)として日米で承認されている核酸医薬の形態には、脊髄性筋萎縮症に対するPS+2’MOE とデュシェンヌ型筋ジストロフィーに対するモルフォリノ核酸があります(図2)。これらには、自己のヌクレアーゼによって分解されないように、また、標的配列との特異性を高めるために修飾・骨格の改良がされています。脊髄性筋萎縮症は、SMN遺伝子の変異によってSMNタンパク質を発現させることができないことが原因ですが、相同遺伝子であるSMN2遺伝子からもわずかに同じSMNタンパク質が産生されています。SMN2遺伝子ではスプライシング異常(エクソンスキップ)が原因でSMNタンパク質の発現が低いため、PS+2’MOEによってこのエクソンが正常に含まれるように誘導することでSMNタンパク質の産生が増加し、治療効果を示します。また、デュシェンヌ型筋ジストロフィーでは、スプライシング異常によって早期に終止コドンが出現してしまいジストロフィンタンパク質を発現させることができないので、モルフォリノ核酸によって終止コドンを含むエクソンを丸ごとスキップさせることで、ジストロフィンタンパク質を発現できるようになり治療効果が現れます。さらに、究極の個別化治療として「N of 1( エヌオブワン)医療」が実践されつつあります。非常に稀な神経難病であるバッテン病の一人の女児に生じている遺伝子変異に対して、この患者さんの配列だけに特異的な核酸医薬をボストン小児病院で設計・開発し、実際に投与されて臨床的効果が確認されました(文献5)。
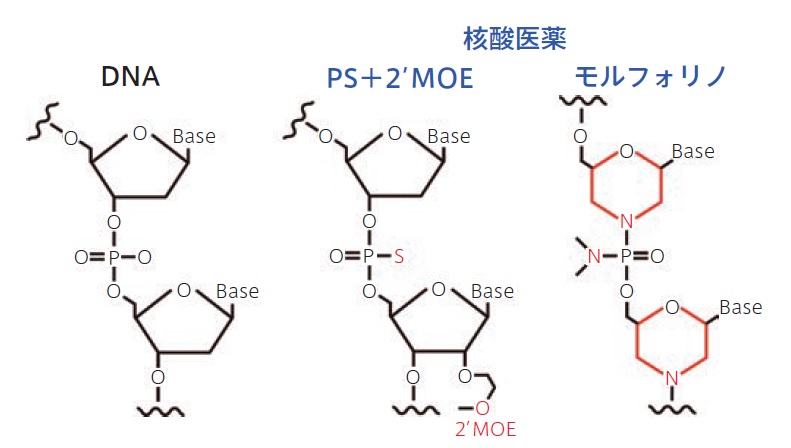
図2 核酸医薬
発がん遺伝子ファミリーRASの弱点に対する核酸医薬の応用
KRAS、NRAS、HRAS遺伝子はRASファミリー遺伝子と呼ばれる最多の発がん遺伝子ファミリーで、全てのがんの約3割で変異が検出されます。遺伝子自体の発見から約40 年経ちますが、これらのタンパク質構造に薬剤が結合できるポケットがないため長年治療薬開発が困難でした。2021年にKRASG12C変異がんを特異的に阻害する薬剤が承認され、注目されています。
今回、これまでの薬剤耐性の研究の延長として、EGFR変異肺がんがEGFR阻害剤で治療された後の薬剤耐性機序としてのKRAS変異の役割を調べました。その際に、CRISPR-Cas9によってEGFR変異細胞株を直接ゲノム編集して様々なKRAS変異を起こすことで、「薬剤耐性の有無=発がん性の有無」として評価できるモデルを構築しました(文献6,7)。KRAS G12C、G12D、A146T変異は予想通り薬剤耐性を示しましたが、KRAS Q61K変異だけはなぜか耐性となりませんでした。このKRAS Q61Kは、肺がん・大腸がんなどの発がん遺伝子変異として確立しているにも関わらず、薬剤耐性とならない(=発がん性がない)という予想外のデータでした。詳細な解析を進めていくと、KRAS Q61K単独では発がん性がなく、すぐ隣のコドンG60にアミノ酸を変化させない「サイレント変異G60G」が同時に起こると初めて発がん性を持つことを発見しました(図3)。
サイレント変異は従来その名の通り「サイレント」、つまり「アミノ酸を変化させない=タンパク質も変わらない=生体における機能も変わらない」として臨床的に無視され、次世代シークエンサーで検出されても報告すらされない類の変異ですが、そのようなサイレント変異が発がんに必須という驚くべき事実でした。発がん変異KRAS Q61Kが生じると異常なスプライシングによってがんは自滅してしまうところを、サイレント変異を生じさせて巧妙に回避する仕組みを解明しました。
さらに解析を進めると、実はKRAS Q61Kだけでなく、RASファミリー遺伝子KRAS、NRAS、HRAS のQ61周辺には、スプライシングに関する致命的な弱点があり、まるでがんが弱点を守るかのようにスプライシング制御因子 ESE(Exonic Splicing Enhancer)が集中していることを見つけました(図3)。
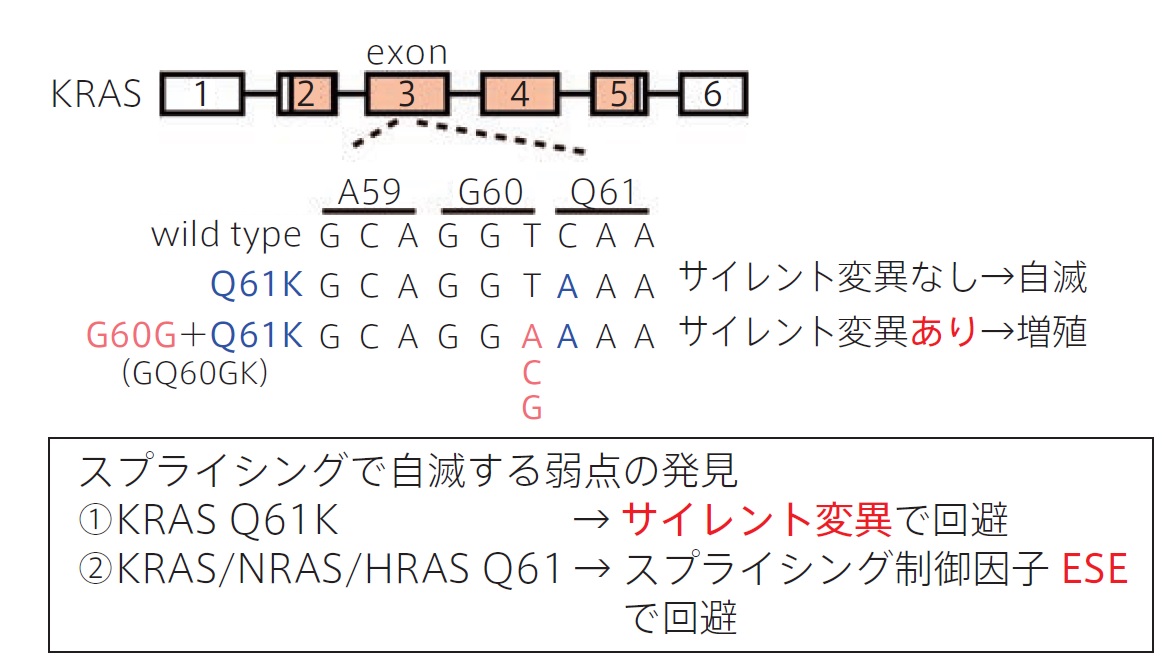
図3 RAS変異がんのスプライシングに関する弱点
2017年に近畿大学 藤井政幸教授より「日本核酸医薬学会シンポジウム異分野融合国際ワークショップ」で発表の機会を頂いたことを思い出して、これらの機序に基づいて核酸医薬でスプライシング異常を誘導してがん治療に応用することを試みました。RAS変異配列に特異的な核酸医薬によってSRタンパク質とESEの結合を阻害すれば、がんはエクソンスキップによって自滅し、一方で正常細胞の野生型配列には理論上結合しないので副作用の軽減が期待できると考えました。初めて使う核酸医薬でしたが、大阪大学小比賀聡教授、ボストン小児病院中山東城先生(現・東京医科歯科大学)からご助言を頂きましたおかげで、proof of conceptとしてのモルフォリノ、PS+2’MOEによる治療効果を細胞実験とマウス実験から示すことができました(図4、文献8)。

図4 核酸医薬でがん細胞だけを攻撃する治療戦略
終わりに
新たな核酸医薬が次々と開発されつつあり、希少疾患に対す
るN of 1医療の推進など核酸医薬業界はますます活発になっています。一方、がん治療への応用に向けた取り組みはまだ始まったばかりで、課題・障壁は山積です。日本核酸医薬学会よりお声がけ頂いて、核酸医薬の勉強をさせてもらいながら学会運営にも関わらせて頂いています。
がん研究者の立場から、核酸医薬とがん治療の融合とその臨床応用に向けて精進したいと思っています。
参考文献
- Kobayashi, Y. et al., J. Thorac. Oncol. 8, e75~78,(2013).
- Kobayashi, Y. et al., Clin. Cancer Res. 21, 5305~5313,(2015).
- Kobayashi, Y. et al., Mol. Cancer Ther. 16, 357~364,(2017).
- Kobayashi, Y. et al., J. Thorac. Oncol. 13, 727~731,(2018).
- Kim, J. et al., N. Engl. J. Med. 381, 1644~1652,(2019).
- Cooper, A#. and Kobayashi Y#. et al.,Clin. Cancer Res. 26, 4072~4079,( 2020). #co-first
- Kobayashi, Y. et al., Nat. Commun. 13, 5614,(2022).
- Kobayashi, Y*. et al., Nature 603, 335~342,(2022).*co-corresponding
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。

