知りたい!がんに対する免疫反応の仕組みとT細胞療法の開発
京都大学 医生物学研究所 再生免疫学分野 河本 宏 教授
掲載日情報:2022/11/15 現在Webページ番号:65962
追加しました。

がんの免疫療法はこの数年で大きく進展した。抗 CTLA-4 抗体や抗 PD-1 抗体などの免疫チェックポイント阻害剤は様々ながん種に対して効果がある事が示されている。一定の効果がある一方で、抗原非特異的な免疫の活性化であるが故に自己免疫反応を高頻度に惹起するという課題が残されている。また、T細胞そのものを用いる方法も効果をあげている。
例えば CAR-T 療法は白血病やリンパ腫に著効を示している。しかし、現行の T細胞療法は、患者自身の T細胞を利用するため、時間がかかる、高くつく、品質が不安定などの課題が残されている。筆者らはこれらの課題を解決するために iPS 細胞から作製した T細胞を用いる方法を開発してきた。
本稿ではがんに対する免疫反応の仕組みを概説した後、免疫チェックポイント阻害剤の作用機序を解説し、その後 T細胞療法の現状と課題について論じる。
がんに対する免疫反応は抑制されている
まずそもそも「免疫は普段がん細胞を殺傷しているか?」という点を論じよう。免疫は元来は病原体を排除するための仕組みであるが、がんに対して免疫系が働くことを特別に「免疫監視機構」(Immune surveillance)という。この問題に関しては、実は「免疫監視機構は存在するが、大した事はしていない」という理解が正しい。多くの人が「毎日何千個も発生するがん細胞を免疫細胞が殺してくれている」という話( 図 1A )を信じているが、そんな事は実際には起こっていない。この話は「加齢やストレスで免疫が低下すると、がんが育ってしまう」という言説につながるのであるが、若い人にがんが少ないのは、免疫細胞ががん細胞を殺してくれているからではなく、若い人ではそもそもがんがほとんど発生していないからである。
がん患者の免疫系で何が起こっているかを見ていこう。免疫監視機構はほとんど働いていないという話はしたが、「免疫系はがんに対して何も反応していない」( 図 1B )というのも正しくない。がんは、他の正常組織に出ていないタンパク質を出しており、これらは免疫系の標的になりうる。従って、「がんに対して免疫反応は多かれ少なかれ起こっている。しかし、様々な抑制性の仕組みによって、免疫反応が作動しなくなっている」という理解が正しい( 図 1C )。この抑制には、末梢レベルで起こる自己寛容誘導メカニズムが働いている。また、がん細胞が、免疫抑制的な環境を周囲に作り出して、免疫系の攻撃を逃れているという要素もある。
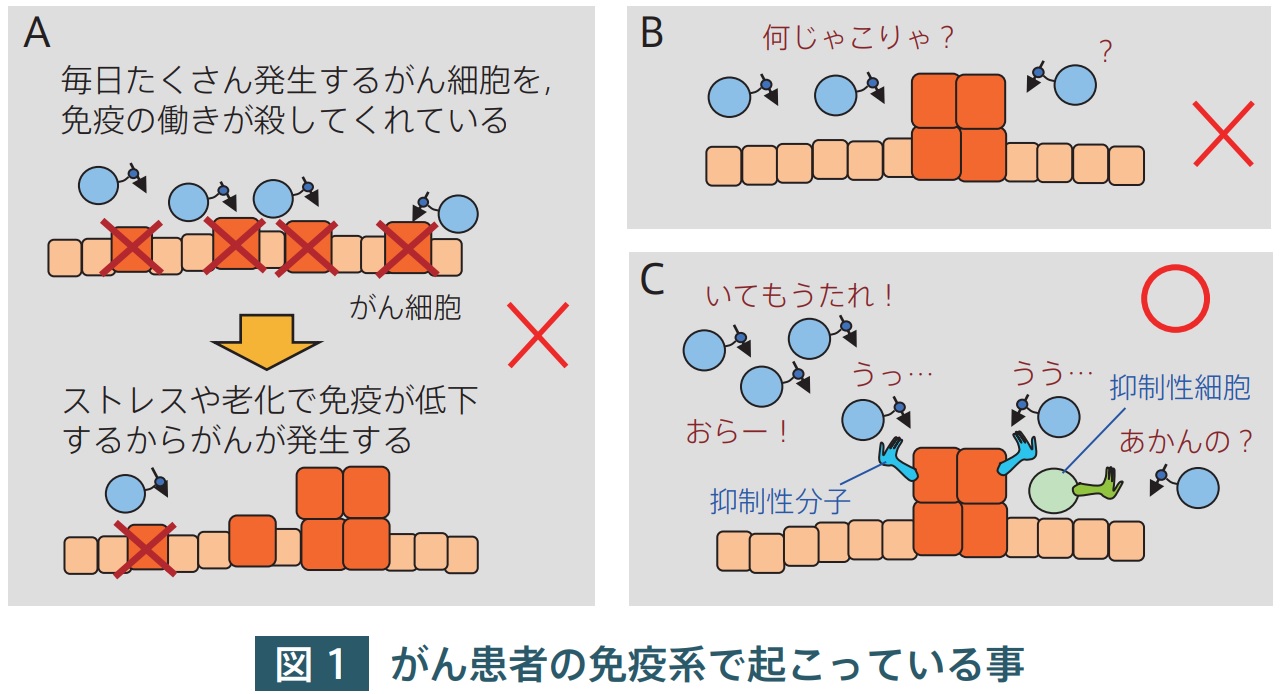
A. 多くの人が信じているモデル
「がんが毎日何千個も発生しているが、免疫系が殺傷してくれている。加齢やストレス
で免疫機能が落ちると、がんが発症する」というモデル。こんな事は実際には起こっていない。
B. 免疫系はがんに全く反応できないというモデル
一部のがんに対してはほとんど免疫反応が起こっていないということはありえる。しかし、多くの場合、多かれ少なかれ、がんに対して免疫反応が起こっていると考えられる。
C. 多くのがん患者で起こっている免疫状態のモデル
がんに免疫反応は起こっているが、様々な自己寛容誘導機構により抑制されて発揮できていない。
免疫チェックポイント阻害剤の作用機序
がんの免疫療法は長い間標準療法に昇格できずにいた。しかし、2010 年に画期的な論文が発表された1。免疫チェックポイント阻害剤である抗 CTLA-4 抗体が転移性悪性黒色腫に有効であることが示されたのである。2012 年には、抗 PD-1 抗体も悪性黒色腫に有効であることが示された2。その後抗 PD-1 抗体は様々ながん種に有効であることが示され、現在多くの種類のがんに対して承認されている。
以下に、免疫チェックポイント阻害剤の作用機序を概説する。がん細胞に対して、がん抗原を取り込んだ樹状細胞がキラー T細胞を活性化し、活性化されたキラー T細胞が攻撃を加える( 図 2A )。しかし、制御性 T細胞は樹状細胞の働きを阻害することにより抗腫瘍免疫を抑制する( 図 2B )。この時、制御性T細胞が発現する CTLA-4 が重要な働きをしている。一方、がん細胞は PD-L1 を発現して、キラー T細胞が出している PD-1に抑制性シグナルを送り、キラー T細胞の活動を阻害する( 図 2B )。ここに抗 CTLA-4 抗体あるいは抗 PD-1 抗体を加えると、これらの抑制性のメカニズムをキャンセルすることができる( 図 2C )ので、キラー T細胞ががんを攻撃できるようになる( 図 2D )。
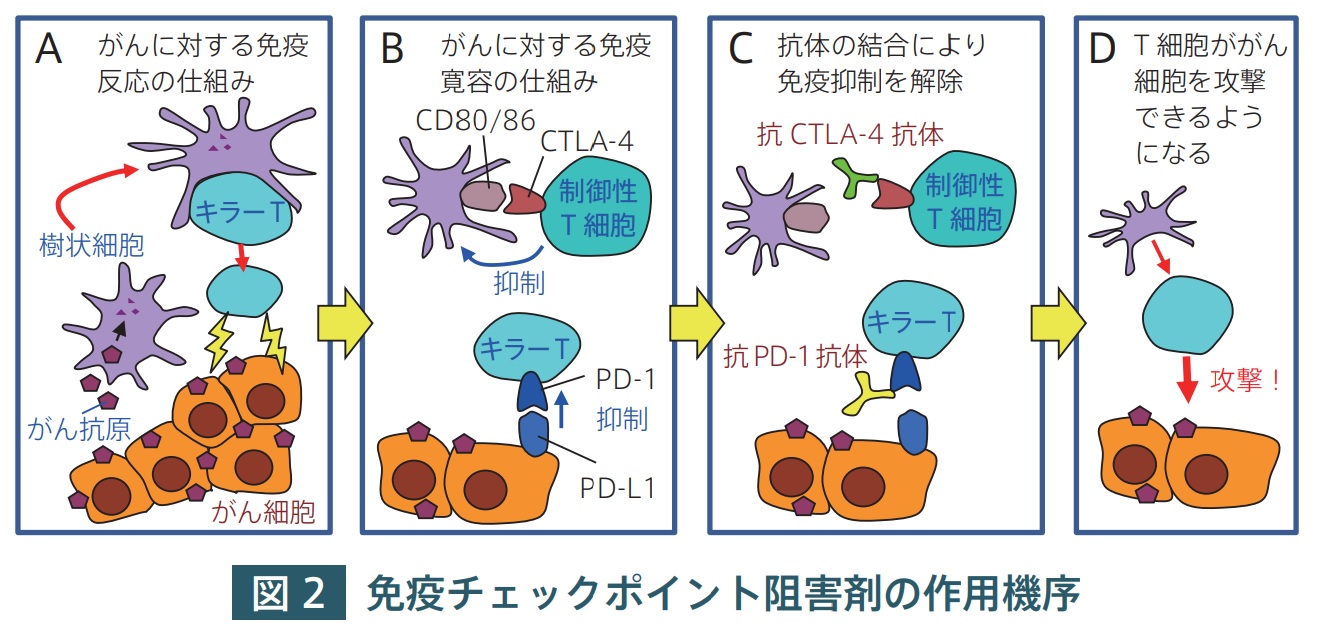
A. がん抗原を取り込んだ樹状細胞がキラー T 細胞を活性化し、活性化されたキラー T 細胞が攻撃を加える。
B. しかし、制御性 T細胞は樹状細胞の働きを阻害する。がん細胞は PD-L1 を発現して、キラー T 細胞の活動を阻害する。
C. 抗 CTLA-4 抗体あるいは抗 PD-1 抗体を加えると、これらの抑制性のメカニズムをキャンセルすることができる。
D. キラー T 細胞ががんを攻撃できるようになる。
ここでは両者の作用点が違うということが重要なポイントである。単独でも効果があるが、併用すると相乗効果が望めるからである。なお、ここではごく単純化したモデルを書いたが、実際の作用点に関して未解明な部分も多いと考えられている。さて、ブレイクスルーとして大いに注目されている免疫チェックポイント阻害剤であるが、課題はある。抗 CTLA-4 抗体も、抗 PD-1 抗体も、実は特効薬というにはほど遠い。いろいろな種類のがんに対して承認されているが、奏功率はせいぜい20~30% くらいである。また、自己免疫反応が 50~80%、重度のケースが 10~20% と、高率に免疫関連の副作用が出現する。さらに、低頻度ではあるが、むしろがんの進行を速めてしまうというケースが見られる。
自家の T細胞を用いるがん免疫療法の現状と課題
免疫チェックポイント阻害剤が頭角を現す一方で、T細胞そのものを用いる方法もほぼ同じ時期に臨床応用が進んだ。T細胞
を体外に取り出してから活性化 / 増幅して戻す方法を養子免疫療法と呼ぶ。例えば腫瘍に浸潤するリンパ球(tumorinfiltrating lymphocyte:TIL)を用いる方法3 や、患者の末梢血中の T細胞にがん抗原特異的な T細胞レセプター(T cellreceptor:TCR)遺伝子を導入するという方法4 などは、一定の効果が示されてきた。さらにキメラ抗原レセプタ ー(chimeric antigen receptor:CAR)を末梢血 T細胞に導入する治療法(CAR-T 療法)は B 細胞性白血病やリンパ腫に著効を示し5、日本を含む世界各国ですでに承認されている。
これらの T細胞を用いた細胞療法の有効性が示される一方で、課題も多く残されている。原則的に自家の系で行われている( 図 3A )ために、ⅰ)作製できる細胞数に限りがある、ⅱ)製造に時間がかかる(数週間)、ⅲ)コストがかかる、ⅳ)患者から品質の良い T細胞が得られるとは限らない、などの課題が存在する。
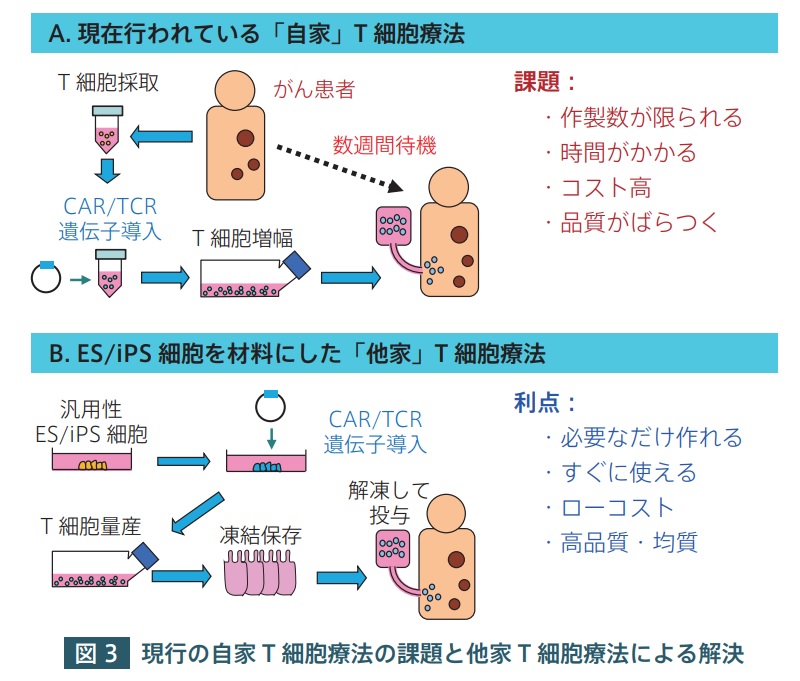
A. 現在行われている「自家」T 細胞療法。患者から T 細胞を採取し、TCR 遺伝子や CAR遺伝子を導入して、活性化/増幅などの処置をした後に、患者に戻す。作製数が限られる、時間がかかる、高くつく、品質がばらつくなどの課題が残されている。
B. 筆者らが開発を進めている、ES/iPS 細胞を材料にした「他家」T 細胞療法。拒絶されにくい HLA 型の細胞、あるいは HLA を欠損した細胞を用いることで汎用性が高まる。
必要な数だけ作れる、すぐに投与できる、安く作れる、均質かつ高品質、などが利点となる。
他家 T細胞を用いる戦略
前述したⅰ)~ⅳ)の課題を解決するために、筆者らは「他家」の T細胞を用いる戦略を進めている( 図 3B )。他家 T細胞の作製には、材料として ES 細胞や iPS 細胞などの多能性幹細胞を使う。特定の反応性を有する T細胞を作製するために、ES/iPS 細胞の段階で CAR遺伝子や TCR遺伝子を導入するという方法をとっている。材料として患者に拒絶されにくいES/iPS 細胞を用いると、汎用性の高い他家 T細胞製剤を作製できる。あらかじめ作って凍結保存しておけば即納型製剤として使える。この方法を用いれば、ⅰ)必要なだけの細胞数が得られる、ⅱ)すぐに投与できる、ⅲ)大量生産できるのでコストを抑えられる、ⅳ)高品質で均質な細胞を提供できる、などが利点となる。
上記のようなコンセプトに基づいて、筆者らは他家 T細胞療法の開発を進めてきた。まず T細胞から iPS 細胞を作製する方法(T-iPS 細胞法)を用いて、2013年にヒトがん抗原特異的 T細胞の再生に成功し6、その後高品質なキラー T細胞の分化誘導に成功した7。次に特定の TCR 遺伝子をiPS細胞に導入する方法(TCR-iPS細胞法)を開発した8。この方法を用いて再生した WT1抗原特異的キラー T細胞は腎細胞がんの患者由来ゼノグラフトモデルで腫瘍の増殖を抑制した9。
現在、WT1抗原を発現する急性骨髄性白血病を対象とした開発研究を、京都大学附属病院の血液・腫瘍内科、先端医療研究開発機構(iACT)、細胞療法センター(C-RACT)などと共同で進めており、2024年に臨床試験を施行する予定である。iPS細胞研究財団(CiRA-F)から提供された汎用性が高いiPS細胞株10 と、すでに自家の系で臨床試験で安全性と一定の有効性が示された WT1抗原特異的TCR遺伝子11を用いている。骨髄移植の適応のない高齢患者で、化学療法で一旦寛解を得た後に再発した症例では、現時点では有効な手段はほぼ無い。末梢血のWT1抗原のmRNAをモニターすることで、再発した直後の腫瘍細胞数の少ない時期に治療を開始することができると考えている。
T細胞療法の展望
ここまでに書いてきたように、細胞療法は、自家移植から汎用性細胞を用いた他家移植へと向かっている。そのような流れの中で、ES/iPS細胞技術を用いた「即納型T細胞製剤」戦略が実現すれば、がん治療に大きなブレイクスルーをもたらすことになると期待される。
なお、汎用性T細胞製剤を用いた治療法は、がんだけでなく、ウイルス感染症にも使える。キラーT細胞の本来の役割はウイルス感染細胞を殺傷する事だから、むしろより効果を発揮できるであろう。現在、造血幹細胞移植後のサイトメガロウイルス感染症に対してT細胞製剤を用いる治療法の開発研究を、藤田医科大学で進めている。この戦略の開発が進めば、将来新たなウイルスによるパンデミックが起こった際に、迅速に対応できると期待される。また、SARSやMERSなどといった致死率が高い既存のウイルス感染症に対して、あらかじめT細胞製剤を備蓄しておくという戦略も考えられる。

京都大学 医生物学研究所 再生免疫学分野の皆様
(前列左から3人目が河本先生)
参考文献
- Hodi FS. et al., N Engl J Med. 2010; 363: 711~723.
- Topalian SL. et al., N Engl J Med. 2012; 366: 2443~2454.
- Rosenberg SA. Nat Rev Clin Oncol. 2011; 8: 577~585.
- Robbins PF. et al., J Clin Oncol. 2011; 29: 917~924.
- Grupp SA. et al., N Engl J Med. 2013; 368: 1509~1518.
- Vizcardo R. et al., Cell Stem Cell. 2013; 12: 31~36.
- Maeda T. et al., Cancer Res. 2016; 76: 6839~6850.
- Maeda T. et al., Mol Ther Methods Clin Dev. 2020; 19:250~260.
- Kashima S. et al., iScience. 2020; 23: 100998
- Okita K. et al., Nat Methods. 2011; 8: 409~412.
- Tawara I. et al., Blood. 2017; 130: 1985~1994.
追加しました。
お問い合わせ先
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。

