細胞接着性測定キット CytoSelect 48-Well ECM Cell Adhesion Assays
掲載日情報:2023/03/08 現在Webページ番号:64366
各種細胞外マトリックス(ECM)タンパク質に対する細胞の接着性を細胞の計数を必要とせずに、比色法または蛍光法により簡便、迅速に測定するキットです。4種類のECMがプレートの各ウェルにコートされたECM Arrayと、単一のECMがコートされた製品があります。
追加しました。
細胞接着とは
細胞接着は胚形成、遊走/浸潤、組織修復および創傷治癒に関与する複雑なプロセスです。これらのプロセスを実行するために、細胞は細胞骨格の構成要素と複合体を形成し、接着レセプターを介して細胞外マトリックス(ECM)成分に接着します。それにより、最終的に細胞運動性や分化、増殖、生存に影響を及ぼします。
追加しました。
特長
- プレートの各ウェルに対象の細胞外マトリックス(ECM)タンパク質がそれぞれ均一にコートされています。
- 細胞の計数は必要ありません。
- 比色法と蛍光法のキットがあります。
追加しました。
製品カテゴリー
※ カテゴリー名をクリックすると製品詳細をご覧いただけます。追加しました。
製品ラインナップ
ECM Array
※ 商品コードをクリックすると価格表をご覧いただけます。| 品名 | Cell Adhesion Assays, ECM Array | |
|---|---|---|
| 商品コード | CBA-070 | CBA-071 |
| コートされた 細胞外マトリックスタンパク質 |
| |
| プレートレイアウト | 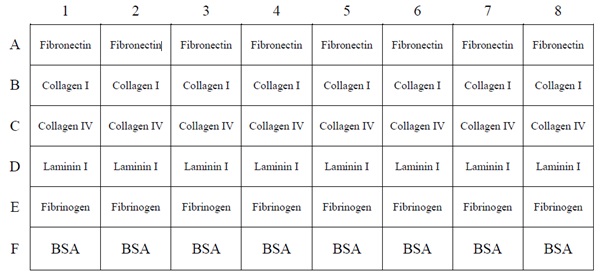 | |
| 測定方法 | 比色 | 蛍光 |
| 測定波長 | 560 nm | 励起 480 nm/蛍光 520 nm |
| キット内容 |
|
|
Fibronectin
※ 商品コードをクリックすると価格表をご覧いただけます。| 品名 | Fibronectin Cell Adhesion Assays | |
|---|---|---|
| 商品コード | CBA-050 | CBA-051 |
| コートされた 細胞外マトリックスタンパク質 | Fibronectin | |
| プレートレイアウト | 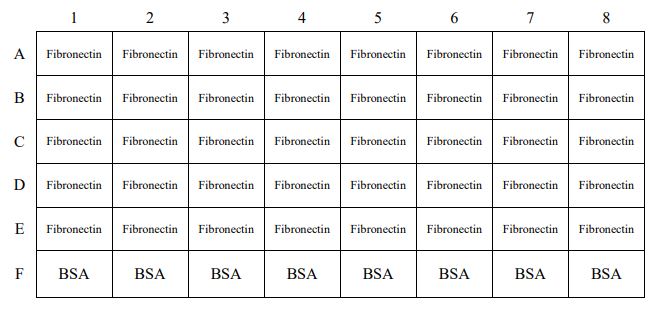 | |
| 測定方法 | 比色 | 蛍光 |
| 測定波長 | 560 nm | 励起 480 nm/蛍光 520 nm |
| キット内容 |
|
|
追加しました。
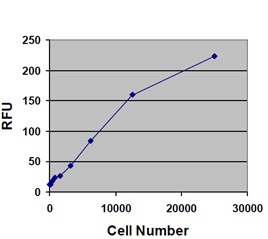
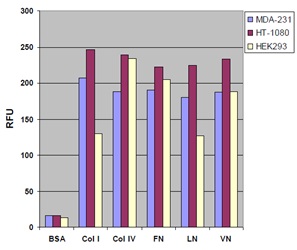
使用例
■比色法による細胞接着の測定例
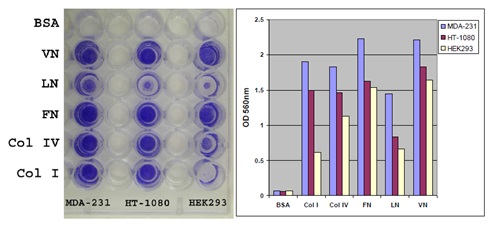
細胞外マトリックス(ECM)を介した細胞接着の実験例
各種細胞(MDA-231、HT-1080、HEK293)100,000 cells/wellを血清飢餓条件で1時間、ECM adhesion plateで培養した。接着した細胞を染色し(左)、抽出後にOD560を測定した(右)。
BSA:ウシ血清アルブミン、VN:ビトロネクチン、LN:ラミニン、FN:フィブロネクチン、Col:コラーゲン
※本製品のプレートにはVN:ビトロネクチンは実際には含まれません。
■蛍光法による細胞接着の測定例
追加しました。
操作方法概略
- ECMがコートされたプレートに細胞懸濁液を加えて培養し、接着させる。
- 非接着細胞をPBSで洗浄し、取り除く。
- 接着した細胞を溶解・染色後、溶解液を96ウェルプレートに移し、プレートリーダーあるいは蛍光プレートリーダーで測定する。
追加しました。
FAQ
Q-1. ECM Array(#CBA-070、#CBA-071)でコートされている細胞外マトリックス(ECM)タンパク質の由来は?
A-1. プレートにコートされているECMタンパク質は、マウスラミニン、ウシコラーゲンⅠ、ヒトフィブロネクチン、ヒトコラーゲンⅣ、ヒトフィブリノーゲンです。
Q-2. BSAがネガティブコントロールとして使用されるのはなぜですか?
A-2. ECMへの細胞接着はすべてインテグリンレセプターを介して行われ、細胞はBSAをコートしたウェルには接着しないためにBSAがネガティブコントロールとして使用されています。
Q-3. プレートは1回ですべてを使い切る必要がありますか?
A-3. 製品はストリップウェルプレートで提供されていませんが、未使用のウェルは溶液が他の未使用のウェルに漏れ出ていない限り、後ほどの実験に使用可能です。再使用の前に、フード内でプレートにUVライトを照射することをお勧めします。
Q-4. どのくらいのコンフルエンシーが推奨されますか?
A-4. 細胞接着アッセイには、50~75%のコンフルエンシーの細胞を推奨します。
Q-5. なぜ無血清培地がプロトコルで必要とされているのですか?
A-5. 血清には多くのECMが含まれており、これらがプレートのウェルにコートされる恐れがあるため、無血清培地を使用することが重要です。血清含有培地を使用した場合には得られる結果が複雑となり、細胞がプレートにコートされた特有のタンパク質に結合したのか、血清中に含まれる多くのECMの中の一つに結合したのかを知ることが不可能になります。多くの細胞株にとって10%FBS含有培地が生育に好ましいですが、このアッセイの間においてFBSなしで短時間インキュベートしても、通常は問題にはなることはありません。
Q-6. キットに含まれるECMタンパク質の生物種とは別の生物種の細胞にも適合しますか?
A-6. 細胞のECMタンパク質への接着は、生物種の適合性やECMタンパク質が生物種間においてどのくらい保存されているかということには依存しません。むしろ接着性は、結合に必要なインテグリンの発現の有無に依存します。例えば、マウス細胞がフィブロネクチンへの結合のためにインテグリンレセプターを発現している場合、その細胞はヒトおよびマウスのフィブロネクチンの両方に結合することができるでしょう。このアッセイがマウス細胞と適合するかどうかを知るためには、使用する細胞株がこれらのECMタンパク質への結合のためのインテグリンレセプターを発現するかどうかを決定する必要があります。
Q-7. 細胞懸濁液調製の際に使用するトリプシンは、細胞表層レセプターを切断しますか?
A-7. トリプシン/EDTAは、細胞接着アッセイの細胞懸濁液の調製の際の細胞の剥離に常に用いられます。細胞接着レセプターは、トリプシン/EDTAによる剥離後も素早く再生します。トリプシン/EDTAが細胞にとって強すぎると考えられる場合には、緩和な無酵素細胞剥離試薬Versene(0.2gEDTA(Na4) /1L PBS)の使用をご検討下さい。
Q-8. ポジティブコントロールとして使用できる細胞株は?
A-8. MDA-MB-231、HT-1080、HEK293細胞においてこのアッセイを検証しています。中でもMDA-MB-231細胞を用いた場合が、最も個々のECMタンパク質に対して接着を示しました。これらの細胞は、この細胞接着アッセイの良いポジティブコントロールとなるでしょう。
追加しました。
価格
[在庫・価格 :2026年02月18日 18時35分現在]
| 詳細 | 商品名 |
|
文献数 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
CytoSelect 48-well Cell Adhesion Assay (ECM Array, Colorimetric) (48assays) |
|
27 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CytoSelect 48-well Cell Adhesion Assay (ECM Array, Colorimetric) (5×48assays) |
|
22 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CytoSelect 48-well Cell Adhesion Assay (ECM Array, Fluorometric) (48assays) |
|
8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CytoSelect 48-well Cell Adhesion Assay (ECM Array, Fluorometric) (5×48assays) |
|
8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[在庫・価格 :2026年02月18日 18時35分現在]
CytoSelect 48-well Cell Adhesion Assay (ECM Array, Colorimetric) (48assays)
文献数: 27
- 商品コード:CBA-070
- メーカー:CBO
- 包装:1kit
- 価格:¥171,000
- 在庫:無(未発注)
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | 各種細胞外マトリックスタンパク質に対する細胞の接着性を比色法により簡便に測定できるキット。 |
||||||
|---|---|---|---|---|---|---|---|
| 別包装品 | 別包装品あり | ||||||
| 法規制等 | |||||||
| 保存条件 | 4℃ | 法規備考 | |||||
| 掲載カタログ |
|
||||||
| 製品記事 | Cell Biolabs(セルバイオラボ)社製品特集 |
||||||
| 関連記事 | |||||||
CytoSelect 48-well Cell Adhesion Assay (ECM Array, Colorimetric) (5×48assays)
文献数: 22
- 商品コード:CBA-070-5
- メーカー:CBO
- 包装:1kit
- 価格:ご照会ください
- 在庫:無(未発注)
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | 各種細胞外マトリックスタンパク質に対する細胞の接着性を比色法により簡便に測定できるキット。 |
||||||
|---|---|---|---|---|---|---|---|
| 別包装品 | 別包装品あり | ||||||
| 法規制等 | |||||||
| 保存条件 | 4℃ | 法規備考 | |||||
| 掲載カタログ |
|
||||||
| 製品記事 | Cell Biolabs(セルバイオラボ)社製品特集 |
||||||
| 関連記事 | |||||||
CytoSelect 48-well Cell Adhesion Assay (ECM Array, Fluorometric) (48assays)
文献数: 8
- 商品コード:CBA-071
- メーカー:CBO
- 包装:1kit
- 価格:¥184,000
- 在庫:無(未発注)
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | 各種細胞外マトリックスタンパク質に対する細胞の接着性を簡便に蛍光測定できるキット。 |
||||||
|---|---|---|---|---|---|---|---|
| 別包装品 | 別包装品あり | ||||||
| 法規制等 | |||||||
| 保存条件 | 4℃ | 法規備考 | |||||
| 掲載カタログ |
|
||||||
| 製品記事 | Cell Biolabs(セルバイオラボ)社製品特集 |
||||||
| 関連記事 | |||||||
CytoSelect 48-well Cell Adhesion Assay (ECM Array, Fluorometric) (5×48assays)
文献数: 8
- 商品コード:CBA-071-5
- メーカー:CBO
- 包装:1kit
- 価格:ご照会ください
- 在庫:無(未発注)
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | 各種細胞外マトリックスタンパク質に対する細胞の接着性を簡便に蛍光測定できるキット。 |
||||||
|---|---|---|---|---|---|---|---|
| 別包装品 | 別包装品あり | ||||||
| 法規制等 | |||||||
| 保存条件 | 4℃ | 法規備考 | |||||
| 掲載カタログ |
|
||||||
| 製品記事 | Cell Biolabs(セルバイオラボ)社製品特集 |
||||||
| 関連記事 | |||||||
[在庫・価格 :2026年02月18日 18時35分現在]
| 詳細 | 商品名 |
|
文献数 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
CytoSelect 48-well Cell Adhesion Assay (Fibronectin, Colorimetric) (48assays) |
|
11 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CytoSelect 48-well Cell Adhesion Assay (Fibronectin, Fluorometric) (48assays) |
|
0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
[在庫・価格 :2026年02月18日 18時35分現在]
CytoSelect 48-well Cell Adhesion Assay (Fibronectin, Colorimetric) (48assays)
文献数: 11
- 商品コード:CBA-050
- メーカー:CBO
- 包装:1kit
- 価格:¥121,000
- 在庫:無(未発注)
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | ヒトフィブロネクチンをコーティングしたプレートにより細胞接着を評価するキット。プレートリーダーを用いて,簡単・高感度に比色定量することができる。 |
||
|---|---|---|---|
| 法規制等 | |||
| 保存条件 | 4℃ | 法規備考 | |
| 掲載カタログ |
|
||
| 製品記事 | Cell Biolabs(セルバイオラボ)社製品特集 |
||
| 関連記事 | |||
CytoSelect 48-well Cell Adhesion Assay (Fibronectin, Fluorometric) (48assays)
文献数: 0
- 商品コード:CBA-051
- メーカー:CBO
- 包装:1kit
- 価格:¥132,000
- 在庫:無(未発注)
- 納期:1週間程度 ※※ 表示されている納期は弊社に在庫がなく、取り寄せた場合の目安納期となります。
- 法規制等:
| 説明文 | ヒトフィブロネクチンをコーティングしたプレートにより細胞接着を評価するキット。蛍光プレートリーダーを用いて,簡単・高感度に定量することができる。 |
||
|---|---|---|---|
| 法規制等 | |||
| 保存条件 | 4℃ | 法規備考 | |
| 掲載カタログ |
|
||
| 製品記事 | Cell Biolabs(セルバイオラボ)社製品特集 |
||
| 関連記事 | |||
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。