発現タンパク質や未知タンパク質のN末端アミノ酸配列を確認! ペプチドシークエンス受託サービス
掲載日情報:2020/08/18 現在Webページ番号:4764
ペプチドシークエンス受託サービスは、タンパク質のアミノ酸配列をEdman分解法により、N末端から高感度に決定する受託サービスです。
※ 本サービスは株式会社ニッピで行われていたサービスが移管されたものです。
※ 本製品は研究用です。研究用以外には使用できません。
追加しました。
ペプチドシークエンス解析例
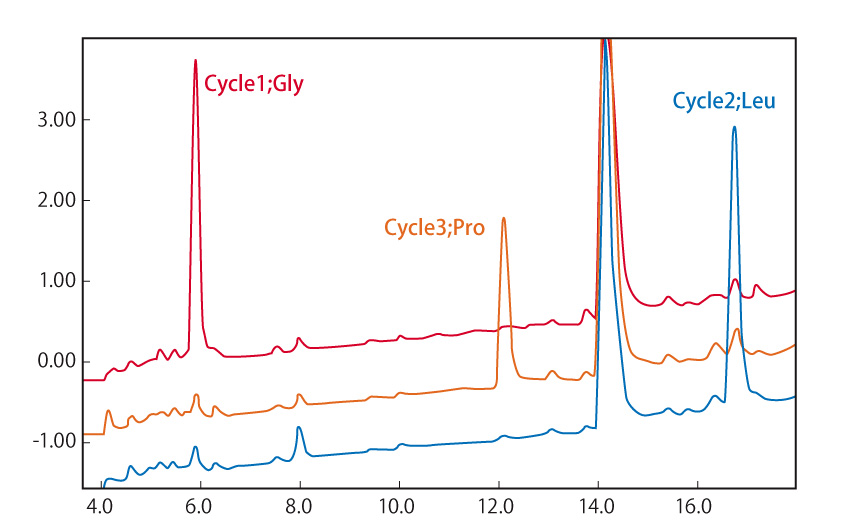
追加しました。
解析試料について
以下のような試料のN末端アミノ酸配列確認に有用です。
- 化学合成されたペプチド
- 単離・精製したタンパク質
- 未知タンパク質
- リコンビナントタンパク質
- プロセシングされたタンパク質
追加しました。
特長
- 精製したタンパク質・ペプチドのアミノ酸配列をN末端側から 1残基ずつ順次同定することが可能です。
- 質量分析のようにデータベースに依存しないため、配列情報が乏しいタンパク質の解析にも適しています。
※ 分析試料に複数のタンパク質が混合している際は、 複数候補となり、配列の特定が困難になる場合があります。
追加しました。
ご用意いただく試料
- 必要試料量:10 pmol以上
- 試料形態:転写済みPVDFメンブレンまたは溶液(脱塩*済み)
* お勧め脱塩カラム
追加しました。
試料準備手順
解析を行う試料については、以下のようにご準備いただくようお願いいたします(⇒手順のダウンロード )
)
ブロッティング方法
目的のタンパク質をブロッティング装置によりPVDF膜へ転写して下さい。使用する膜は、ミリポア製イモビロンPを推奨しております。ニトロセルロース膜は、絶対に使用しないで下さい。ブロッティングの際は以下の点に留意して下さい。タンパク質がPVDF膜に十分に転写されたら、下記の「転写後の操作について」に従って下さい。
- 転写緩衝液は、一般的な緩衝液(例:3.3 g/l Tris、14.4 g/l グリシン、10~20%メタノール)を使用して下さい。その他の緩衝液(アミノカプロン酸、ホウ酸)でも構いません。
- メタノール濃度は高分子(5万以上)の場合は低めに、低分子(2万以下)の場合は多めにした方が効率良く転写されます。
- 充分に転写されるようであれば、特に添加物は必要ありません。塩基性タンパク質や高分子(10万以上)の場合、0.01%SDSを加えると転写効率が改善する場合があります。
- 低分子(1万以下)の場合は、イモビロンP_SQという厚めの膜の方が良いと言われております。
転写後の操作について
- 転写済みPVDF膜を0.1%クマシーブリリアントブルーR250、50%メタノール溶液に浸漬します。染色液は使い回したものを使用しないで下さい。また、容器とピンセットも清浄なものを使用して下さい。
- 1分間程度緩やかに振盪し、膜全体が染まったら、染色液を捨てます。
- 50%メタノールを加え、30秒間程度緩やかに振盪した後、液を捨てます。
- バックグランドが脱色され、タンパク質のバンドが見えるまで3.の操作を繰り返します。タンパク質のバンドが消えないように注意して下さい。
- 新しい容器に膜を移し替え、超純水(例:Milli-Q水)ですすぎます。1分間程度振盪した後、液を交換します。これを10回繰り返して下さい。すすぎはとても重要な工程です。
- 濾紙上でPVDF膜を乾燥させます。濾紙を交換しつつ、濾紙が濡れなくなるまで良く乾かして下さい。PVDF膜は濡れていると透明感がありますので、白くなるまで乾燥させて下さい。
- 乾いたPVDF膜から、ディスポーザブルの剃刀で目的のバンドを切り取り、エッペンドルフチューブに入れて常温で保管して下さい。膜の乾燥が不完全でも、冷蔵保管であれば問題ありません。
追加しました。
価格
基本料金
1試料(5残基まで):¥48,000
6残基以降、1残基ごとに追加料金:¥4,500
※ 液状サンプルでも転写済みのメンブレンでも解析価格は一律となります。
※ N末端ブロックなどで読めない場合も5残基までデータをとります。
オプション料金
脱塩、濃縮(ProSorbによる):¥15,000
システイン残基検出(還元アルキル化): ¥30,000
※ 試料の状態、実験の目的によって作業が異なります。
※ 詳細については当社受託・特注品業務担当までお問い合わせ下さい。
追加しました。
ご注文方法
N末端ペプチドシークエンス分析依頼書( :約60 KB)に必要事項をご記入の上、販売担当者にお渡し下さい。
:約60 KB)に必要事項をご記入の上、販売担当者にお渡し下さい。
追加しました。
FAQ
Q-1. 使用機器は何ですか?
A-1. Applied Biosystems社のProcise492HTです。
Q-2. サンプル量はどのくらい必要ですか?
A-2. 基本的な装置の性能は10 pmol以上となっています。これより微量でも解析できる場合もありますが、試料の純度はより重要な要素です。
Q-3. システインは検出できますか?
A-3. システイン残基は壊れてしまい検出できません。必要な場合は、還元アルキル化が必要です。日本皮革研究所で行う場合は、4-ビニルピリジンでアルキル化し、追加料金30,000円となります。
Q-4. 溶液の分析もできますか?
A-4. 試料以外の不揮発性成分を含まなければ、分析可能です。緩衝液、塩類を含む場合は脱塩が必要です。日本皮革研究所で脱塩する場合は15,000円追加料金となります。
Q-5. アクリルアミドゲルの状態で分析できますか?
A-5. アクリルアミドゲルからは分析できません。ブロットが必須です。
Q-6. ニトロセルロース膜に転写した試料も分析できますか?
A-6. ニトロセルロースは、ペプチドシークエンスの試薬に耐性がないため、使用できません。
Q-7. PVDF膜の染色は何が良いですか?
A-7. 染色は、CBB R250が最も適しています。感度が良く、分析を妨害しません。
Q-8. リン酸化は検出できますか?
A-8. リン酸化スレオニン、リン酸化チロシンは検出できません。リン酸化セリンは感度が落ちますがデヒドロアラニンとして検出可能な場合があります。
Q-9. N末がブロックされている可能性があります。
A-9. N末が、アセチル化、ピログルタミル化など、ブロックされていると分析できません。デブロックは日本皮革研究所では受託しておりません。
Q-10. 解析残基数を決めずに、読めるだけ読んで欲しいのですが。
A-10. ご相談下さい。
Q-11. 読めなかった場合も料金はかかるのですか?
A-11. 読めなくても試薬は同じだけ使用しますので、料金はかかります。
Q-12. 糖鎖があるとどうなりますか?
A-12. 糖鎖のついた残基は、検出されず、そのサイクルはブランクとなります。
Q-13. 複数のペプチドが混ざっている場合はどうなりますか?
A-13. 単一に精製された試料を分析することが基本的な考えです。複数混ざっている場合は、その割合を反映した結果となります。配列既知のペプチドの場合は比較的解釈が容易ですが、未知のペプチドの場合は配列の特定ができない場合もあります。
Q-14. PVDF膜に転写した試料はどのように送ればよいですか?
A-14. PVDF膜に転写された試料は乾燥していれば安定ですので、充分乾燥させて目的のバンドを切り抜き、エッペンドルフ型チューブなどに入れて室温でお送り下さい。CBBは分析を妨害しないのと、弊社でトリミングをする場合がありますので、試料はCBBで染まっていた方が良いです。バックグラウンドは脱色して下さい。また、乾燥させる前に、清浄な容器と純水で充分すぎるほどすすいで下さい。
Q-15. 溶液の試料はどのように送ればよいですか?
A-15. 溶液の場合は、現在保管されている状態(冷蔵あるいは冷凍)でお送り下さい。凍結融解を最小限にするためです。
Q-16. 粉末、固体の試料は分析できますか?
A-16. 凍結乾燥などされた試料は、日本皮革研究所で0.1%TFA / 20%アセトニトリルに溶解して分析します。より適切な溶媒がわかっている場合は、お知らせ下さい。
追加しました。
おすすめ製品記事
-
株式会社バイオ未来工房
/ 骨芽細胞の検出に
Alizarin Red S染色キット
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。


