抗Phosphoserine抗体 | Anti-Phosphoserine antibody
掲載日情報:2018/10/03 現在Webページ番号:252152
StressMarq Biosciences社の抗Phosphoserine抗体(Anti-Phosphoserine antibody)です。
※本製品は研究用です。研究用以外には使用できません。
カートに商品を
追加しました。
追加しました。
価格
[在庫・価格 :2026年03月01日 00時00分現在]
※ 表示されている納期は弊社に在庫が無く、取り寄せた場合の納期目安となります。
| 詳細 | 商品名 |
|
文献数 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Anti-Phosphoserine, Polyclonal, HRP Conjugate |
|
本製品は取扱中止になりました | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[在庫・価格 :2026年03月01日 00時00分現在]
※ 表示されている納期は弊社に在庫が無く、取り寄せた場合の納期目安となります。
Anti-Phosphoserine, Polyclonal, HRP Conjugate
文献数: 1
- 商品コード:SPC-151F
- メーカー:STQ
- 包装:400μl
- 本製品は取扱中止になりました
| 説明文 | |||
|---|---|---|---|
| 法規制等 | |||
| 保存条件 | 法規備考 | ||
| 抗原種 | 免疫動物 | Rabbit | |
| 交差性 | Species Independent | 適用 | ELISA,IC,IF,IHC,IP,Western Blot |
| 標識 | HRP | 性状 | Affinity Purified |
| 吸収処理 | クラス | ||
| クロナリティ | Polyclonal | フォーマット | |
| 掲載カタログ |
|
||
| 製品記事 | 抗リン酸化アミノ酸抗体 |
||
| 関連記事 | |||
カートに商品を
追加しました。
追加しました。
製品情報
Product Name
Phosphoserine Antibody
Clonality
Polyclonal
Description
Rabbit Anti-Phosphoserine Polyclonal
Research Areas
Cell Signaling, Phosphorylation, Post-translational Modifications
Alternative Names
Phospho-ser Antibody, pS Antibody, pSer Antibody, Phospho-serine antibody
Host Species
Rabbit
Immunogen
Phosphoserine conjugated to KLH, and phosvitin mixture
Applications
WB, IHC, ICC/IF, IP, ELISA
Species Reactivity
Species Independent
Specificity
Detects proteins phosphorylated on serine residues. Does not cross-react with phosphotyrosine.
Purification
Peptide Affinity Purified
Storage Buffer
PBS, 50% glycerol, 0.01% sodium azide
Certificate of Analysis
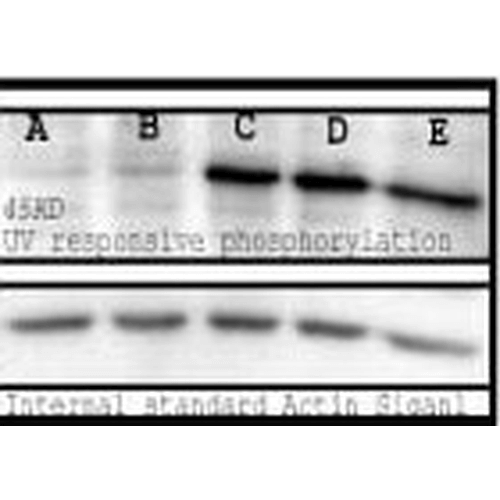
2 µg/ml of SPC-149 was sufficient for detection of phosphorylation signal in western blot analysis using human MMRU cells treated with 0.1 µM okadaic acid.
References
Scientific Background
Protein phosphorylation is an important posttranslational modification that serves many key functions to regulate a protein’s activity, localization, and protein-protein interactions. Phosphorylation is catalyzed by various specific protein kinases, which involves removing a phosphate group from ATP and covalently attaching it to to a recipient protein that acts as a substrate. Most kinases act on both serine and threonine; others act on tyrosine, and a number (dual specificity kinases) act on all three. Because phosphorylation can occur at multiple sites on any given protein, it can therefore change the function or localization of that protein at any time (1). Changing the function of these proteins has been linked to a number of diseases, including cancer, diabetes, heart disease, inflammation and neurological disorders (2-4).
References
1. Goto H. et al. (2005) Nature Cell Biology 8: 180-187.
2. Blume-Jensen P. and Hunter T. (2001) Nature 411: 355-365.
3. Downward J. (2001) Nature 411: 759-762.
4. Pawson T. and Saxton T.M. (1999) Cell 97: 675-678.
5. Ostrovsky P.C. (1995) Genes Dev. 9(16): 2034-2041.
Protein phosphorylation is an important posttranslational modification that serves many key functions to regulate a protein’s activity, localization, and protein-protein interactions. Phosphorylation is catalyzed by various specific protein kinases, which involves removing a phosphate group from ATP and covalently attaching it to to a recipient protein that acts as a substrate. Most kinases act on both serine and threonine; others act on tyrosine, and a number (dual specificity kinases) act on all three. Because phosphorylation can occur at multiple sites on any given protein, it can therefore change the function or localization of that protein at any time (1). Changing the function of these proteins has been linked to a number of diseases, including cancer, diabetes, heart disease, inflammation and neurological disorders (2-4).
References
1. Goto H. et al. (2005) Nature Cell Biology 8: 180-187.
2. Blume-Jensen P. and Hunter T. (2001) Nature 411: 355-365.
3. Downward J. (2001) Nature 411: 759-762.
4. Pawson T. and Saxton T.M. (1999) Cell 97: 675-678.
5. Ostrovsky P.C. (1995) Genes Dev. 9(16): 2034-2041.
カートに商品を
追加しました。
追加しました。
製品情報は掲載時点のものですが、価格表内の価格については随時最新のものに更新されます。お問い合わせいただくタイミングにより製品情報・価格などは変更されている場合があります。
表示価格に、消費税等は含まれていません。一部価格が予告なく変更される場合がありますので、あらかじめご了承下さい。